题目内容
16.反应2SO2+O2?2SO3达到平衡后,再向反应器中充入由18O组成的氧气,经一段时间后,18O可能存在于( )| A. | 生成的SO3中 | B. | O2和SO3中 | C. | 剩余的SO3中 | D. | O2、SO2和SO3中 |
分析 从化学键角度来说,化学反应本质是旧键断裂,形成原子,原子重新组合,形成新键.可逆反应不可能100%地全部转化,据此判断.
解答 解:反应过程中化学键断裂,存在原子有S原子、16O原子、18O原子,原子重新组合生成物质,二氧化硫、氧气在催化剂、加热的条件下,生成三氧化硫;而三氧化硫在同样的条件下可分解为二氧化硫和氧气,所以18O2中的18O通过化合反应存在于SO3中,SO3 中的18O通过分解反应会存在于SO2中,最终SO3、SO2、O2中都含有18O.
故选D.
点评 本题以同位素示踪法考查可逆反应的可逆性,比较基础,注意可逆反应不能进行到底,无论进行多长时间,反应物都不可能100%地全部转化为生成物.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.(1)已知反应:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液
变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下:
其他条件不变时:探究温度对化学反应速率的影响,应选择实验②④(填实验编号);若同时选择实验①②、实验②③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中a和b分别为5.0和10.0.
(2)某同学设计如下实验流程探究Na2S2O3的化学性质.

实验操作①中测试时pH试纸的颜色应该接近D.
A.红色 B.黄色 C.深蓝色 D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的还原性.
变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下:
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | V(Na2S2O3)/mL | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | V(H2O)/mL |
| ① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
| ③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
| ④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |
(2)某同学设计如下实验流程探究Na2S2O3的化学性质.

实验操作①中测试时pH试纸的颜色应该接近D.
A.红色 B.黄色 C.深蓝色 D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的还原性.
11.随着环保意识增强,清洁能源越来越受到人们关注.
(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(1)═H2O(g),△H=+44.0kJ•mol-l
则4.8g甲烷气体完全燃烧生成液态水,放出的热量为267.1kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206.1kJ•mol-l.
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表.
则此时正、逆反应速率的关系是a.(填序号)
a.v(正)>v(逆) b.v(正)<v(逆)
c.v(正)=v(逆) d.无法判断
②为了探究温度、压强对上述化学反应速率的影响,某学习小组进行了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
表中P1=303,P2=101;
实验2、3的目的是探究温度对化学反应速率的影响.
实验1、2、3中反应的化学平衡常数的大小关系是K1=K3<K2 (用K1、K2、K3表示).
(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-802.3kJ•mol-1
H2O(1)═H2O(g),△H=+44.0kJ•mol-l
则4.8g甲烷气体完全燃烧生成液态水,放出的热量为267.1kJ.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206.1kJ•mol-l.
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表.
| CH4 (g) | H2O (g) | CO (g) | H2 (g) |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
a.v(正)>v(逆) b.v(正)<v(逆)
c.v(正)=v(逆) d.无法判断
②为了探究温度、压强对上述化学反应速率的影响,某学习小组进行了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
| 实验序号 | 温度/℃ | 压强/kPa | V(CH4)/mol•L-1•s-1 | V(H2O)/mol•L-1•s-1 |
| 1 | 360 | P1 | 0.100 | 0.100 |
| 2 | 480 | 101 | 0.120 | 0.120 |
| 3 | 360 | P2 | 0.080 | 0.080 |
实验2、3的目的是探究温度对化学反应速率的影响.
实验1、2、3中反应的化学平衡常数的大小关系是K1=K3<K2 (用K1、K2、K3表示).
8.有机物甲可氧化生成羧酸,也可以还原生成醇.由甲生成的羧酸与醇在一定条件下反应可以生成化合物乙,其分子式为C2H4O2.下列叙述中正确的是( )
| A. | 甲分子中氢的质量分数为40% | |
| B. | 甲和由甲生成的羧酸与醇三者均可溶于水 | |
| C. | 甲在常温常压下为无色液体 | |
| D. | 乙和甲的最简式不同 |
5.将两个铂电极插人KOH溶液中,向两极分别通人CH4和O2,构成甲烷燃料电池.已知.通入CH4的一极,其电极反应式是:CH4+10OH--8e-═CO32-+7H2O;另一极通入O2.下列叙述不正确的是( )
| A. | 通人CH4的电极为负极 | |
| B. | 正极发生氧化反应 | |
| C. | 燃料电池工作时,溶液中的OH-向负极移动 | |
| D. | 该电池使用一段时间后应补充KOH |
6.X、Y、Z是短周期的三种相邻元素,X与Y同主族,Y与Z同周期,已知三种元素族序数之和为16,原子序数之和为38,则X、Y、Z的元素符号为( )
| A. | Na、K、Ca | B. | N、P、S | C. | F、Cl、S | D. | O、S、Cl |
 X与氢元素形成的化合物的电子式是[H:]-Ca2+[:H]-.
X与氢元素形成的化合物的电子式是[H:]-Ca2+[:H]-.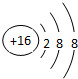 ;D与E能形成一种分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是硫化氢(填名称);X与E形成的离子化合物 XE2中有(填“有”“无”)共价键.
;D与E能形成一种分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是硫化氢(填名称);X与E形成的离子化合物 XE2中有(填“有”“无”)共价键.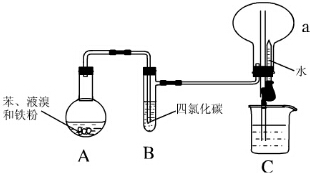 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应. .
.