题目内容
15.能正确表示下列反应的离子方程式的是( )| A. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| C. | 钠与盐酸反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 铝跟氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+H2↑ |
分析 A.钠与水反应生成氢氧化钠和氢气;
B.钠与硫酸铜溶液不会置换出金属铜;
C.钠优先与氢离子反应生成氢气;
D.2mol铝完全反应生成3mol氢气,该反应不满足电子守恒.
解答 解:A.钠与水反应生成NaOH和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A正确;
B.钠与水硫酸铜溶液反应生成硫酸钠、氢氧化铜沉淀和氢气,正确的离子方程式为:2Na+2H2O+Cu2+═H2↑+2Na++Cu(OH)2↓,故B错误;
C.钠与盐酸反应生成氯化钠和氢气,正确的离子方程式为:2Na+2H++═2Na++H2↑,故C错误;
D.铝跟氢氧化钠溶液反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故D错误;
故选A.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.向含有c(FeCl3)=0.2mol•L-1、c(FeCl2)=0.1mol•L-1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3nm的金属氧化物,下列有关说法中正确的是( )
| A. | 该分散系是纯净物 | |
| B. | 可用过滤的方法将黑色金属氧化物与Na+分离开 | |
| C. | 加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-═Fe3O4+4H2O | |
| D. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 |
6.下列有关方程式书写正确的是( )
| A. | 醋酸溶液与氢氧化钠溶液反应的离子方程式为H++OH-═H2O | |
| B. | H2O的电离方程式:H2O+H2O?H3O++OH- | |
| C. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O (g)△H=-890.3 kJ•mol-1 | |
| D. | 双氧水中加入稀硫酸和KI溶液:H2O2+2I-+H+═I2+2H2O |
3.25℃时,pH=9的NaHA溶液中各微粒的物质的量浓度关系正确的是( )
| A. | c(A2-)>c(H2A) | B. | c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-) | ||
| C. | c(Na+)=c( HA-)+c(H2A) | D. | c(H+)=c(A2-)+c(OH-) |
10.某化学小组用如图所示的装置制取氯气,下列说法不正确的是( )
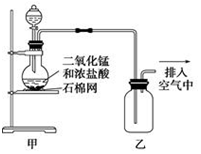

| A. | 该装置图中至少存在两处明显错误 | |
| B. | 在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 | |
| C. | 烧瓶中的MnO2可换成KMnO4 | |
| D. | 在集气瓶的导管口处放一片湿润的淀粉--KI试纸可以证明是否有氯气逸出 |
20.下列说法中,正确的是( )
| A. | SO2能使FeCl3、酸性KMnO4溶液迅速褪色 | |
| B. | 可以用澄清石灰水来鉴别SO2与CO2 | |
| C. | 氨气和酸相遇都能产生白色烟雾 | |
| D. | 在反应NH3++H+=NH4+中,氨失去电子被氧化 |
4.下列实验中红,对应的实验现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 用pH试纸测定等浓度的HCl、H2SO4两溶液的pH | 测定HCl溶液的pH试纸更红 | 非金属性Cl>S |
| B | 将AgCl和AgBr的饱和溶液等体积混合 | 出现淡黄色沉淀 | Ksp(AgBr)<Ksp(AgCl) |
| C | 向Al2(SO4)3溶液中滴加过量氢氧化钡溶液 | 生成白色沉淀 | A l(OH)3 不溶于氢氧化钡溶液 |
| D | 将Fe(NO3)2 样品溶于稀硫酸,滴加KSCN溶液 | 溶液变红 | Fe(NO3)3 样品溶于稀硫酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
18.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知H2O(l)=H2O(g)△H=+44 kJ/mol,则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的热量 | |
| C. | 硝酸铵溶于水温度降低,这个过程发生的是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下△H的相同 |