题目内容
 如图是电解200mL 1mol?L-1 CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
如图是电解200mL 1mol?L-1 CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )| A、a为负极,b为正极 |
| B、a为阳极,b为阴极 |
| C、电解过程中,c电极质量减少、d电极质量增加 |
| D、如果阴极上有1.6 g铜析出,则阳极上产生气体的体积(标准状况)约为0.56 L |
考点:电解原理
专题:电化学专题
分析:在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极,以此根据电解池的工作原理来解答.
解答:
解:在电解池中,电流的流向和电子的移动方向相反,电流是从正极流向阳极,所以c是阳极,d是阴极,a是正极,b是负极.
A.a是正极,b是负极,故A错误;
B.a是正极,b是负极,故B错误;
C.电解过程中,c是阳极,该极上会析出氯气,d是阴极,该极上会析出金属铜,故C错误;
D、如果阴极上有1.6g即0.025mol铜析出,根据电极反应Cu2++2e-=Cu,转移电子是0.05mol,阳极上发生反应:2Cl--2e-=Cl2↑,此时产生气体0.025mol,体积(标准状况)为0.025mol×22.4L/mol=0.56 L,故D正确.
故选D.
A.a是正极,b是负极,故A错误;
B.a是正极,b是负极,故B错误;
C.电解过程中,c是阳极,该极上会析出氯气,d是阴极,该极上会析出金属铜,故C错误;
D、如果阴极上有1.6g即0.025mol铜析出,根据电极反应Cu2++2e-=Cu,转移电子是0.05mol,阳极上发生反应:2Cl--2e-=Cl2↑,此时产生气体0.025mol,体积(标准状况)为0.025mol×22.4L/mol=0.56 L,故D正确.
故选D.
点评:本题考查电解池的工作原理,难度不大,会根据电子流向和电流流向判断电源的正负极,从而确定电极的阴阳极,再根据所学知识进行回答.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
某化学反应2X(g)?Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol?L-1)随反应时间(min)的变化情况如下表:
下列说法不正确的是( )
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
| A、C>1.0 |
| B、实验2可能使用了催化剂 |
| C、实验3比实验2先达到化学平衡状态 |
| D、前10分钟,实验4的平均化学反应速率比实验1的大 |
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是( )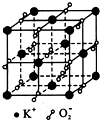

| A、超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- |
| B、晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ |
| C、晶体中与每个K+距离最近的K+有8个 |
| D、晶体中,0价氧原子与-2价氧原子的数目比为1:1 |
在水中加入等物质的量的AgNO3、Ba(NO3)2、NaCl、K2SO4,用惰性电极电解此溶液,通电片刻,则氧化产物与还原产物的质量比为( )
| A、8:1 |
| B、16:207 |
| C、71:2 |
| D、108:35.5 |
 I2在KI溶液中存在下列平衡:I2(aq)+I- (aq)?I3- (aq).某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I- (aq)?I3- (aq).某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A、反应 I2(aq)+I- (aq)?I3- (aq)的△H>0 |
| B、若温度为T1、T2,反应的平衡常数分别为K1、K2则K1>K2 |
| C、若反应进行到状态D时,一定有υ正<υ逆 |
| D、状态A与状态B相比,状态A的c(I2)大 |
某气态烃1mol能和2mol Br2加成,其饱和产物又能和6mol Cl2完全取代,则该烃是( )
| A、C2H6 |
| B、C4H6 |
| C、C3H4 |
| D、C2H2 |
向一由Fe、Cu组成的混合粉末中加入一定量的稀硝酸,充分反应后剩余金属X g,再各其中加入一定量的稀硫酸,充分振荡后余下金属Y g.则x和y之间的关系是( )
| A、X一定大于Y |
| B、X可能等于Y |
| C、X可能小于Y |
| D、X可能大于Y |

