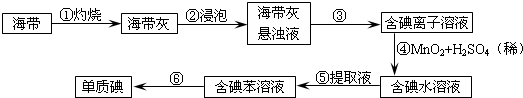
题目内容
19. 化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.
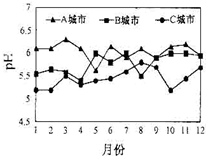
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.(1)A、B、C三个城市全年雨水的月平均pH变化如图所示.
受酸雨危害最严重的是C城市,控制燃煤产生的SO2排放,能减少硫酸型酸雨的形成,减少燃煤过程产生该气体的措施有燃煤脱硫
(列举一条).燃煤产生的CO2用NH3处理可生产多种化工产品,如用液氨与CO2反应可制备尿素[CO(NH2)2].又如用氨水吸收CO2
可制得碳铵(NH4HCO3),写出该反应的离子方程式NH3•H2O+CO2=NH4++HCO3-或NH3+H2O+CO2=NH4++HCO3-.
(2)汽车尾气中含有NO2、NO、CO等有害气体.写出由NO2形成硝酸型酸雨的化学方程式:3NO2+H2O=2HNO3+NO;汽车安装尾气热催化净化装置可将NO、CO转化为无害气体,写出该反应的化学方程式:2NO+2CO$\frac{\underline{催化剂}}{△}$N2+2CO2.
(3)高档外墙的复合保温材料采用铝合金锁边.有关铝合金的性质正确的是b(填字母).
a.强度小 b.耐腐蚀 c.密度大
(4)氮化硅是一种新型高温材料,可用于制造汽车发动机.请写出高纯硅和氮气在高温(1300℃)时反应制备氮化硅的化学方程式:2N2+3Si$\frac{\underline{\;高温\;}}{\;}$Si3N4.
分析 (1)雨水的pH越小,酸性越强,受酸雨危害越严重;煤中加入适量石灰石,煤燃烧产生的二氧化硫会与碳酸钙分解生成的氧化钙反应生成亚硫酸钙,亚硫酸钙不稳定,被氧气氧化为硫酸钙,即为碳酸钙与氧气、二氧化硫反应生成硫酸钙与二氧化碳;氨气、二氧化碳、水反应生成碳酸氢铵;
(2)二氧化氮与水反应生成硝酸和NO;汽车生产的有害气体为NO、CO,通过催化剂转化为无害气体,反应应生成氮气与二氧化碳,据此写出反应的化学方程式;
(3)合金的特点:熔点比成分金属低;硬度比成分金属大、性能和强度都优于纯金属;
(4)反应物硅和氮气,反应条件1300℃,产物氮化硅,配平化学方程式即可.
解答 解:(1)由图可知C城市雨水pH最小,故受酸雨危害最严重的是C城市;
煤中加入适量石灰石,煤燃烧产生的二氧化硫与碳酸钙、氧气、二氧化硫反应生成硫酸钙与二氧化碳,从而可以大大减少煤燃烧时SO2的排放;氨气、二氧化碳、水反应生成碳酸氢铵:CO2+H2O+NH3=NH4HCO3,离子方程式:NH3•H2O+CO2=NH4++HCO3-或NH3+H2O+CO2=NH4++HCO3-,
故答案为:C;燃煤脱硫;NH3•H2O+CO2=NH4++HCO3-或NH3+H2O+CO2=NH4++HCO3-;
(2)二氧化氮与水反应生成硝酸与NO,反应离子方程式为:3NO2+H2O=2HNO3+NO;
汽车生产的有害气体为NO、CO,通过催化剂转化为无害气体,反应应生成氮气与二氧化碳,反应方程式为:2NO+2CO$\frac{\underline{催化剂}}{△}$N2+2CO2,
故答案为:3NO2+H2O=2HNO3+NO;2NO+2CO$\frac{\underline{催化剂}}{△}$N2+2CO2;
(3)铝合金具有强度大、耐腐蚀、密度小于成分金属的特点,故答案为:b;
(4)已知反应物硅和氮气,反应条件1300℃,产物氮化硅,配平化学方程式即可:2N2+3Si$\frac{\underline{\;高温\;}}{\;}$Si3N4,故答案为:2N2+3Si$\frac{\underline{\;高温\;}}{\;}$Si3N4.
点评 本题考查环境污染与防治、二氧化硫性质、材料等知识,题目难度不大,明确氮的氧化物、硫的氧化物的性质及应用,明确酸雨的成因及治理方法为解答关键,试题培养了学生的灵活应用能力.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案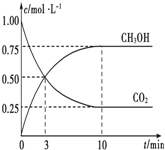 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是( )| A. | 欲增大平衡状态时$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$的比值,可采用升高温度的方法 | |
| B. | 达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 欲提高H2的平衡转化率只能加压减小反应容器的体积 | |
| D. | 从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol•L-1•min-1 |
| A. | 若X、Y位于第ⅠA族,则X、Y可能与氧元素形成原子个数比为1:1或2:1的化合物 | |
| B. | 若X、Y位于第三周期,则X、Y形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | 若气态HnX的沸点高于HnY,则X、Y只能位于元素周期表的第ⅥA族 | |
| D. | 若X、Y位于周期表的同一周期,则最高价含氧酸的酸性可能是HnXOm>HaYOb |
| A. | 钢铁发生析氢腐蚀时,0.56gFe反应 转移电子数为0.03NA | |
| B. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 1molH2O2分子中的非极性共价键 1NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4 NA |
| A. | 冰融化一一共价键 | B. | 二氧化硅熔融--范德华力 | ||
| C. | 氢氧化钠溶于水--离子键、共价键 | D. | 硫酸氢钠溶于水--离子键、共价键 |
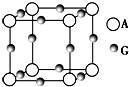 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.