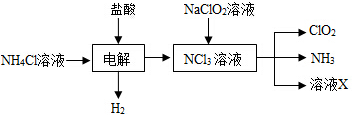
题目内容
17.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA | |
| B. | 标准状况下,4.48 L己烷含有的分子数为0.2NA | |
| C. | 标准状况下,6.72LNO2与水反应消耗的氧化剂分子数为0.2NA | |
| D. | 1 mol OD-离子含有的质子、中子数均为10NA |
分析 A、丙烯和环丙烷的最简式均为CH2;
B、标况下己烷为液态;
C、求出NO2的物质的量,然后根据NO2和水的反应中,3molNO2中有1mol被还原做氧化剂;
D、OD-中含10个电子、9个中子和9个质子.
解答 解:A、丙烯和环丙烷的最简式均为CH2,故42g混合物中含有的CH2的物质的量为n=$\frac{42g}{14g/mol}$=3mol,故含6mol氢原子即6NA个,故A正确;
B、标况下己烷为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、标况下6.72LNO2的物质的量为0.3mol,而NO2和水的反应中,3molNO2中有1mol被还原做氧化剂,故0.3mol二氧化氮中做氧化剂的为0.1mol,分子个数为0.1NA个,故C错误;
D、OD-中含10个电子、9个中子和9个质子,故1mol OD-中含9mol质子和9mol中子即均为9NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
8.如图是5种均含同一元素的物质转化关系图,其中A为单质,则A为( )


| A. | Fe | B. | C | C. | Cl2 | D. | N2 |
12.对于化学反应方向的判断,下列说法中正确的是( )
| A. | 温度、压强一定时,放热的熵减小的反应一定能自发进行 | |
| B. | 温度、压强一定时,焓因素和熵因素共同决定一个化学反应的方向 | |
| C. | 反应焓变是决定反应能否进行的惟一因素 | |
| D. | 固体的溶解过程与熵变无关 |
2.设 NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 17.6 g 丙烷中所含的极性共价键为 4NA | |
| B. | 常温常压下,2.24 L 乙烯中电子总数为1.6NA | |
| C. | 溴乙烷加入NaOH溶液、加热再加入AgNO3有浅黄色沉淀生成 | |
| D. | 26克C2H2、苯、苯乙烯组成的混合物所含碳原子数为2NA |
9.下列有关实验装置的说法,正确的是( )
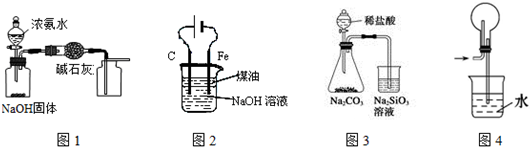

| A. | 用图1装置制取干燥纯净的NH3 | |
| B. | 用图2装置制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | 装置3可证明非金属性Cl>C>Si | |
| D. | 装置4用于HCl的吸收,防止倒吸 |
6.下列关于元素周期表的说法,错误的是( )
| A. | 元素周期表是元素按原子序数大小排列而成的 | |
| B. | 元素原子的电子层数等于其所在周期的周期序数 | |
| C. | 元素原子的最外层电子数等于其所在族的族序数 | |
| D. | 元素周期表中共有18列,16个族 |
7.短周期元素X、Y、Z、W、M的原子序数依次增大,且原子最外层电子数之和为17,X与Y是组成化合物种类最多的元素,W是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径大小顺序:r(Y)>r(Z)>r(W)>r(M) | |
| B. | 由三种元素X、Z、W形成的化合物中只有共价键而无离子键 | |
| C. | Z的气态氢化物比W的气态氢化物更稳定 | |
| D. | 分子式为Y4X8W2的物质超过10种 |
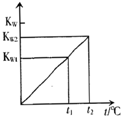 水的离子积常数KW与温度t(℃)的关系如图所示:
水的离子积常数KW与温度t(℃)的关系如图所示: