题目内容
9.下列有关实验装置的说法,正确的是( )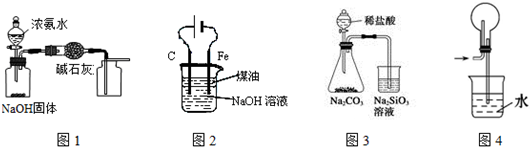
| A. | 用图1装置制取干燥纯净的NH3 | |
| B. | 用图2装置制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | 装置3可证明非金属性Cl>C>Si | |
| D. | 装置4用于HCl的吸收,防止倒吸 |
分析 A.氨气密度小于空气密度,应选择向下排气法;
B.电解池阳极发生氧化反应,阴极发生还原反应;
C.最高价氧化物对应水化物的酸性越强,元素的非金属性越强;
D.倒置的烧瓶能防止倒吸.
解答 解:A.氨气密度小于空气密度,应选择向下排气法,A中采用的是向上排气法,故A错误;
B.铁做电解池的阴极,不参与反应,不能得到氢氧化亚铁,故B错误;
C.盐酸中氯化氢不是氯元素的最高价氧化物的水化物,所以通过实验不能判断Cl与C元素非金属性强弱,故C错误;
D.倒置的烧瓶能防止倒吸,可用于HCl的吸收,故D正确;
故选:D.
点评 本题考查化学实验方案评价,为高频考点,涉及氨气、氢氧化铁的制备、元素非金属性强弱的判断依据、倒吸等,侧重考查学生对实验基础的考查,题目难度不大,注意对知识的积累.

练习册系列答案
相关题目
19.苯丙酸诺龙是一种兴奋剂,结构简式如下,下列有关苯丙酸诺龙的说法中正确的是( )

| A. | 苯丙酸诺龙分子中没有手性碳原子 | |
| B. | 苯丙酸诺龙属于芳香烃 | |
| C. | 苯丙酸诺龙既能使溴的四氯化碳溶液又能使酸性KMnO4溶液褪色 | |
| D. | 1mol苯丙酸诺龙最多可与2 mol的NaOH溶液反应 |
20.下列判断正确的是( )
| A. | 盐酸是化合物 | B. | 只含有一种元素的物质一定是单质 | ||
| C. | CO2、SO2是酸性氧化物 | D. | 纯净物只含有一种元素 |
17.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA | |
| B. | 标准状况下,4.48 L己烷含有的分子数为0.2NA | |
| C. | 标准状况下,6.72LNO2与水反应消耗的氧化剂分子数为0.2NA | |
| D. | 1 mol OD-离子含有的质子、中子数均为10NA |
4.下列有关实验的操作不正确的是( )
| A. | 分液时,分液漏斗内的上层液体应由上口倒出 | |
| B. | 用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 | |
| C. | 配制0.1mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| D. | 检验NH4+时,往试样中加入NaOH溶液,加热,用湿润蓝色石蕊试纸检验逸出的气体 |
14.能实现下列物质间直接转化的元素是( )
单质$\stackrel{+O_{2}}{→}$氧化物$\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
单质$\stackrel{+O_{2}}{→}$氧化物$\stackrel{+H_{2}O}{→}$酸或碱$\stackrel{+NaOH或HCl}{→}$盐.
| A. | 铁 | B. | N2 | C. | 铜 | D. | 硫 |
1.下列说法不正确的是( )
| A. | 干冰可用于人工降雨 | |
| B. | 过氧化钠常用作航天员的供氧剂 | |
| C. | 乘车严禁携带易燃、易爆等危险品 | |
| D. | 大量开采、使用可燃冰不会对环境造成影响 |
19.下列关于卤代烃的叙述错误的是( )
| A. | 随着碳原子数的增多,一氯代烃的沸点逐渐升高 | |
| B. | 随着碳原子数的增多,一氯代烃的密度逐渐增大 | |
| C. | 等碳原子数的一氯代烃,支链越多,沸点越低 | |
| D. | 等碳原子数的一卤代烃,卤素的原子序数越大,沸点越高 |
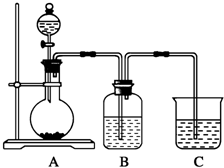 某同学设计实验以探究元素性质的递变规律,实验装置如图所示.
某同学设计实验以探究元素性质的递变规律,实验装置如图所示.