题目内容
16.某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是( )
| A. | 实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2 | |
| B. | 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强 | |
| C. | 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O | |
| D. | 由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应 |
分析 由实验可知,①中发生3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,②中观察到Cu剩余,则硝酸完全反应,③中加稀硫酸,Cu与稀硫酸不反应,但硝酸铜在酸性条件下具有硝酸的强氧化性,继续与Cu反应,以此来解答.
解答 解:A.①中发生3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,生成硝酸铜溶液为蓝色,试管口NO被氧化生成红棕色的二氧化氮,但硝酸被还原生成NO,故A错误;
B.③中加稀硫酸,Cu与稀硫酸不反应,但硝酸铜在酸性条件下具有硝酸的强氧化性,继续与Cu反应,而硝酸的氧化性强,故B错误;
C.实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O,故C正确;
D.由上述实验可得出结论:Cu在常温下可以和稀硝酸反应,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握发生的反应及现象、结论的关系为解答的关键,侧重分析与实验能力的考查,注意硝酸盐在酸性条件下的性质,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
7.下列化学反应的离子方程式能用通式:mM(n+1)++nN═mM+nN(m+1)+表示的是( )
| A. | 氯化锌溶液中投入钠 | B. | 氯化铁溶液中投入铜 | ||
| C. | 硝酸银溶液中投入铜 | D. | 硫酸铜溶液中投入铁 |
4.下列说法不正确的是( )
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 按系统命名法,有机物  的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| C. | 甲烷、甲醛、尿素都不存在同分异构体 | |
| D. | 某有机物含有C、H、O、N四种元素,其球棍模型为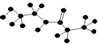 ,该有机物的结构简式为 ,该有机物的结构简式为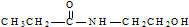 |
8.某学习小组研究“不同条件对化学反应速率影响的研究”,选用4mL0.01mol•L-1KMnO4溶液与2mL0.1mol•L-1H2C2O4溶液在稀硫酸中进行实验,改变条件如表:
(1)如果研究催化剂对化学反应速率的影响,使用实验①和②(用①-④表示,下同);如果研究温度对化学反应速率的影响,使用实验①和③.
(2)对比实验①和④,可以研究草酸的浓度或反应物的浓度对化学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变.
(1)如果研究催化剂对化学反应速率的影响,使用实验①和②(用①-④表示,下同);如果研究温度对化学反应速率的影响,使用实验①和③.
(2)对比实验①和④,可以研究草酸的浓度或反应物的浓度对化学反应速率的影响,实验④中加入1mL蒸馏水的目的是确保①和④组对比实验中c(KMnO4)不变,或确保溶液总体积不变.
| 组别 | 草酸的体积/mL | 温度/℃ | 其它物质 |
| ① | 2mL | 20 | |
| ② | 2mL | 20 | 2滴饱和MnSO4溶液 |
| ③ | 2mL | 30 | |
| ④ | 1mL | 20 | 1mL蒸馏水 |
5.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | pH=a的醋酸溶液,稀释10倍后,其pH=b,则a=b-1 | |
| B. | 含等物质的量的NaHSO3和Na2SO3的溶液:2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)] | |
| C. | 0.1mol•L-1盐酸与0.2mol•L-1氨水等体积混合:c(NH3•H2O)>c(Cl-)>c(NH4+)>c(OH-) | |
| D. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
7.某有机物结构简式如图,下列叙述不正确的是( )
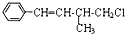
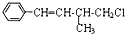
| A. | 该有机物的分子式为C11H13Cl | |
| B. | 该有机物能使溴水褪色 | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物在一定条件下,能发生消去反应或取代反应 |
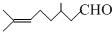 )是合成青蒿素原料之一.
)是合成青蒿素原料之一. .水合氢离子的结构式:
.水合氢离子的结构式: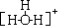 .
.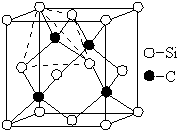 碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题:
碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题: