题目内容
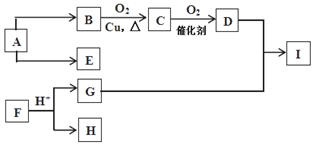
19.下列热化学方程式中,正确的是( )| A. | 已知:H2(g)+F2(g)═2HF(g)△H=-546.6 kJ•mol-1,则1 mol氢气与1 mol氟气反应生成2mol 液态氟化氢放出的热量小于546.6 kJ | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g) 置于密闭容器中充分反应生成NH3(g)放热19.3 kJ.其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4(aq)+Ca(OH)2(aq)═CaSO4(s)+2H2O(l)△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 |
分析 A.物质由气态变为液态,放出热量;
B.氮气与氢气的反应为可逆反应;
C.生成水的同时生成硫酸钙,放出更多的热量;
D.2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则2mol氢气完全燃烧生成液态水,放出571.6 kJ热量.
解答 解:A.液态氟化氢的能量比气态氟化氢的能量低,根据能量守恒,1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量大于546.6 kJ,故A错误;
B.氮气与氢气的反应为可逆反应,如生成1mol氨气,放出热量应大于19.3 kJ,则N2(g)+3H2(g)?2NH3(g)△H<-38.6 kJ•mol-1,故B错误;
C.生成水的同时生成硫酸钙,放出更多的热量,故C错误;
D.2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则2mol氢气完全燃烧生成液态水,放出571.6 kJ热量,则2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,故D正确.
故选D.
点评 本题考查学生对热化学方程式的理解、反应热与能量关系,为高频考点,侧重考查学生的分析能力,难度不大,注意把握物质的状态、反应的特点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下面有关pH的说法正确的是( )
| A. | 在pH=12的溶液中.水电离出的c(OH-)定等于10-12mol/L | |
| B. | 将pH=2和pH=l2的酸碱溶液等体积混合后,溶液的pH一定等于7 | |
| C. | 若强酸、强碱中和后pH=7,则中和之前酸、碱的pH之和一定等于14 | |
| D. | 含等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合后.溶液的pH一定大于7 |
7.下列各组离子在给定条件下一定能大量共存的是( )
| A. | 使pH试纸变蓝的溶液中:Fe3+、NH4+、S2-、SO32- | |
| B. | 能与Al反应产生H2的溶液中:HCO3-、Ba2+、Al3+、Br- | |
| C. | 常温下pH=1的溶液中:Mg2+、Cl-、SO42-、Fe3+ | |
| D. | 由水电离出的c(H+)=1×10-13 mol/L的溶液:K+、AlO2-、Br-、Cl- |
9.高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面.查阅资料得到以下有关高氯酸的信息:
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如图:
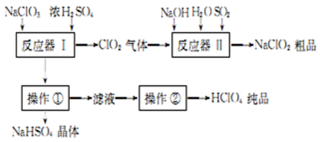
(1)操作①的名称是过滤,操作②的名称是蒸馏.
(2)反应器Ⅰ中发生反应的化学方程式为3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O.
(3)反应器Ⅱ中发生反应的离子方程式为4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O.
(4)若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O.
(5)若想得到201 kg的 HClO4纯品,至少需要NaClO3 639 kg.
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸.写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)HCl+4H2O-8e-=HClO4+8H+.
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |

(1)操作①的名称是过滤,操作②的名称是蒸馏.
(2)反应器Ⅰ中发生反应的化学方程式为3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O.
(3)反应器Ⅱ中发生反应的离子方程式为4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O.
(4)若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O.
(5)若想得到201 kg的 HClO4纯品,至少需要NaClO3 639 kg.
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸.写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)HCl+4H2O-8e-=HClO4+8H+.
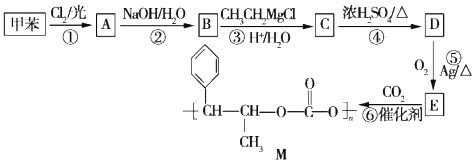
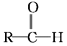 +R′-MgX→
+R′-MgX→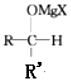 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$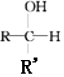 (R,R'均为烃基);
(R,R'均为烃基);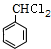 ,D
,D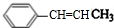 ,E
,E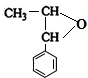 .
. .B与新制的Cu(OH)2悬浊液共热反应
.B与新制的Cu(OH)2悬浊液共热反应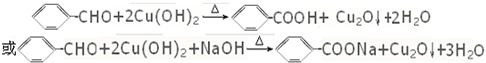 .
.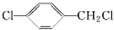 (填结构简式).
(填结构简式).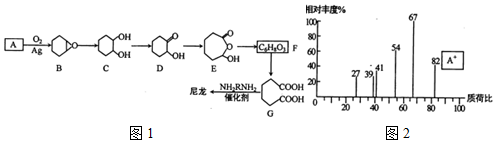
 .
.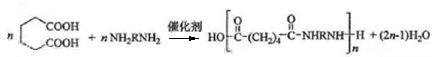 .
.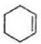 $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$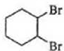 $→_{△}^{NaOH、醇}$
$→_{△}^{NaOH、醇}$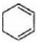 .
.