题目内容
19. 某电解装置如图所示,电解槽内装有淀粉KI溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.下列说法不正确的是( )
某电解装置如图所示,电解槽内装有淀粉KI溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.下列说法不正确的是( )| A. | 石墨电极与电源的正极相连 | |
| B. | 刚开始电解时,左侧溶液的pH增大 | |
| C. | 电解结束时,右侧溶液中含有I- | |
| D. | 电解槽内发生反应的总化学方程式为2KI+2H2O═I2+H2↑+2KOH |
分析 在一定的电压下通电,右侧溶液变蓝色,说明生成I2,则右侧电极为阳极,电极反应为:2I--2e-=I2,左侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,左侧放出氢气,左侧I-、OH-通过阴离子交换膜向右侧移动,右侧发生反应3I2+6OH-=IO3-+5I-+3H2O,所以一段时间后,蓝色变浅,据此分析解答.
解答 解:A.在一定的电压下通电,右侧溶液变蓝色,则生成I2,电极反应为:2I--2e-=I2,所以右侧电极为阳极,右侧石墨电极与电源的正极相连,故A正确;
B.根据以上分析左侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,生成OH-,所以刚开始电解时,左侧溶液的pH增大,故B正确;
C.根据以上分析,左侧I-、OH-通过阴离子交换膜向右侧移动,右侧发生反应3I2+6OH-=IO3-+5I-+3H2O,蓝色变浅,故电解结束时,右侧溶液中含有I-,故C正确;
D.右侧电极为阳极,电极反应为:2I--2e-=I2,同时发生反应3I2+6OH-=IO3-+5I-+3H2O,左侧电极为阴极,电极反应式为:2H2O+2e-=H2↑+2OH-,故总的电极反应式为:KI+3H2O$\frac{\underline{\;通电\;}}{\;}$KIO3+3H2↑,故D错误;
故选D.
点评 本题考查电解原理,明确各个电极上发生的反应及离子移动方向是解本题关键,易错选项是D,注意总反应包括两极发生的所以反应之后,题目难度中等.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
17.已知还原性I->Fe2+>I2,在水溶液中I2可被Cl2氧化为IO3-,向含溶质amol的FeI2溶液中通入bmol Cl2,充分反应(不考虑单质与水的反应).下列说法不正确的是( )
| A. | 当a=2b时,反应后的粒子浓度之比:c(Fe2+):c(I-):c(Cl-)=1:1:1 | |
| B. | 当3a=2b时,发生的离子反应:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- | |
| C. | 当13a=2b时,发生的离子反应:2Fe2++4I-+13Cl2+12H2O═4IO3-+26Cl-+2Fe3++24H+ | |
| D. | 若反应后溶液中I2与IO3-的物质的量为1:1,则反应中转移的电子3.5b mol |
7.现有八种短周期元素a~h的有关性质的数据如下
根据元素周期律,判断下列推断不正确的是( )
| 元素编号 | a | b | c | d | e | f | g | h |
| 原子半径/nm | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.093 |
| 最高化合价或最低化合价 | +1 | -1 | -3 | +3 | -2 | +3 | +1 | -1 |
| A. | 元素a与元素c形成的化合物分子中的化学键是极性键 | |
| B. | b元素形成的氢化物分子间存在氢键 | |
| C. | e元素位于周期表中的第二周期ⅥA族 | |
| D. | 元素f的最高价氧化物的水化物能溶于元素h的最高价氧化物的水化物的水溶液中 |
14.乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断键的说法不正确的是( )
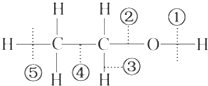

| A. | 和金属钠反应时键①断裂 | |
| B. | 在铜催化共热下与O2反应时断裂①和③ | |
| C. | 在浓H2SO4催化共热下与CH3COOH反应时断裂② | |
| D. | 在空气中完全燃烧时断裂①②③④⑤ |
11.如图是A、B两种物质的溶解度曲线,下列说法不正确的是( )


| A. | A物质的溶解度随温度升高而增大 | |
| B. | t2℃时,A物质的溶解度大于B物质的溶解度 | |
| C. | A的饱和溶液温度越高,溶质质量分数越大 | |
| D. | t1℃时,A、B两种物质饱和溶液的质量分数为25% |
8.下列化合物属于有机物的是( )
| A. | NaCN | B. | CaCO3 | C. | CO(NH2)2 | D. | NH4CNO |
9.下列说法中正确的是( )
| A. | 1mol CO2和1mol CO所占的体积相同,所含分子数相同 | |
| B. | 1g CO和1g CO2所占的体积不同,所含分子数不同 | |
| C. | 在任何情况下,1mol CO2和64g SO2所含有分子数和原子总数都相同 | |
| D. | 某物质若含阿伏加德罗常数个微粒,该物质在标准状况下体积约为22.4L |
