题目内容
8.下列化合物属于有机物的是( )| A. | NaCN | B. | CaCO3 | C. | CO(NH2)2 | D. | NH4CNO |
分析 根据含有碳元素的化合物叫有机化合物,简称有机物;碳的氧化物、碳酸盐、碳酸、氰化物,氰酸盐虽含碳虽含碳,但其性质与无机物类似,因此把它们看作无机物;据此进行分析判断.
解答 解:A.NaCN是含碳的化合物,但其性质与无机物类似,属于无机物,故A错误;
B.碳酸钙是含碳的化合物,但其性质与无机物类似,属于无机物,故B错误;
C.尿素是含碳的化合物,属于有机物,故C正确;
D.NH4CNO是含碳的化合物,但其性质与无机物类似,因此属于无机物,故D错误.
故选C.
点评 本题考查有机物的概念,难度不大,掌握有机物与无机物的概念、特征等是正确解答此类题的关键.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
19. 某电解装置如图所示,电解槽内装有淀粉KI溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.下列说法不正确的是( )
某电解装置如图所示,电解槽内装有淀粉KI溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.下列说法不正确的是( )
 某电解装置如图所示,电解槽内装有淀粉KI溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.下列说法不正确的是( )
某电解装置如图所示,电解槽内装有淀粉KI溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.下列说法不正确的是( )| A. | 石墨电极与电源的正极相连 | |
| B. | 刚开始电解时,左侧溶液的pH增大 | |
| C. | 电解结束时,右侧溶液中含有I- | |
| D. | 电解槽内发生反应的总化学方程式为2KI+2H2O═I2+H2↑+2KOH |
13.三氯化氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂,实验室制取POCl3并测定产品含量的实验过程如下:
I.制备POCl3
采用氧气氧化液态的PCl3法,实验装置(加热及夹持装置省略)及相关信息如下:
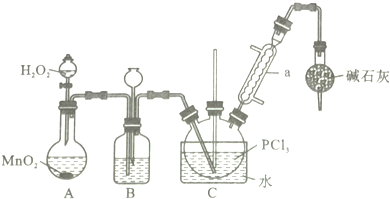
(1)仪器a的名称为冷凝管;
(2)装置C中生成POCl3的化学方程式为PCl3+H2O2=POCl3+H2O;
(3)实验中需控制通入O2的速率,对此采取的操作是控制分液漏斗中双氧水的加入量;
(4)装置B的作用除观察O2的流速之外,还有平衡气压、干燥氧气;
(5)反应温度应控制在60~65℃,原因是温度过低,反应速率小,温度过高,三氯化磷会挥发,影响产物纯度;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液.
(6)达到终点时的现象是溶液变红色;
(7)测得产品中n(POCl3)=0.11mol;
(8)已知Ksp(AgCl)>Ksp(AgSCN),据此判断,若取消步骤③,测定结果将偏低.(填偏高,偏低,或不变)
I.制备POCl3
采用氧气氧化液态的PCl3法,实验装置(加热及夹持装置省略)及相关信息如下:

| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
| POCl3 | 2.0 | 106.0 | 153.5 |
(2)装置C中生成POCl3的化学方程式为PCl3+H2O2=POCl3+H2O;
(3)实验中需控制通入O2的速率,对此采取的操作是控制分液漏斗中双氧水的加入量;
(4)装置B的作用除观察O2的流速之外,还有平衡气压、干燥氧气;
(5)反应温度应控制在60~65℃,原因是温度过低,反应速率小,温度过高,三氯化磷会挥发,影响产物纯度;
II.测定POCl3产品含量的实验步骤:
①实验I结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725g POCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.5mol/L AgNO3标准溶液(Ag++Cl-=AgCl↓)
③加入少量硝基苯(硝基苯密度比水大,且难溶于水)
④以硫酸铁溶液为指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液(Ag++SCN-=AgSCN↓),到达终点时共用去10.00mL KSCN溶液.
(6)达到终点时的现象是溶液变红色;
(7)测得产品中n(POCl3)=0.11mol;
(8)已知Ksp(AgCl)>Ksp(AgSCN),据此判断,若取消步骤③,测定结果将偏低.(填偏高,偏低,或不变)
20.某同学用回收的镁铝合金制取氢气.现有10.8g镁铝合金,下列说法正确的是( )
| A. | 常温下与足量18mol/LH2SO4反应,最多可放出0.6molH2 | |
| B. | 常温下与足量2mol/LHNO3反应,最少可放出0.45molH2 | |
| C. | 常温下与足量2mol/LH2SO4反应,放出H2的量在0.45mol~0.6mol之间 | |
| D. | 常温下与足量2mol/LNaOH反应,放出H2的量在0.45mol~0.6mol之间 |
17.在短周期元素中,属于金属元素的有( )
| A. | 13种 | B. | 9种 | C. | 5种 | D. | 3种 |
18.如图是模拟铁的电化学防护装置.以下叙述正确的是( )
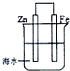

| A. | 此装置属于电解池 | |
| B. | 此装置中的铁做正极,发生氧化反应 | |
| C. | 此装置中电子从锌极流向铁极 | |
| D. | 此装置中的锌做阴极,极反应为:Zn-2e→Zn2+ |



