题目内容
下列有关碱金属元素性质的叙述中,正确的是( )
| A、碱金属的单质中,锂的还原性最强 |
| B、K与水反应最剧烈 |
| C、在自然界中它们无游离态存在 |
| D、单质的熔沸点依次升高 |
考点:碱金属的性质
专题:金属概论与碱元素
分析:A.依据同主族元素从上到下金属性依次增强解答;
B.金属性越强与水反应越剧烈;
C.碱金属活泼性强,很容易与空气中的氧气等发生反应;
D.金属晶体中金属原子的半径越大,金属键越弱,晶体的熔沸点越低.
B.金属性越强与水反应越剧烈;
C.碱金属活泼性强,很容易与空气中的氧气等发生反应;
D.金属晶体中金属原子的半径越大,金属键越弱,晶体的熔沸点越低.
解答:
解:A.同主族元素从上到下金属性依次增强,所以锂的还原性最弱,故A错误;
B.同主族元素从上到下金属性依次增强,碱金属中铷(不考虑放射性元素铯)金属性最强,与水反应最剧烈,故B错误;
C.碱金属活泼性强,很容易与空气中的氧气等发生反应,在自然界中它们只能以化合态存在,故C正确;
D.碱金属从上到下原子半径依次增大,金属键依次减弱,单质的熔沸点依次降低,故D错误;
故选:C.
B.同主族元素从上到下金属性依次增强,碱金属中铷(不考虑放射性元素铯)金属性最强,与水反应最剧烈,故B错误;
C.碱金属活泼性强,很容易与空气中的氧气等发生反应,在自然界中它们只能以化合态存在,故C正确;
D.碱金属从上到下原子半径依次增大,金属键依次减弱,单质的熔沸点依次降低,故D错误;
故选:C.
点评:本题考查了碱金属的性质,本题考查了,注意抓住碱金属性质递变规律分析判断,掌握基础是关键,题目比较简单.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、32g O2气体含有的氧原子数为NA |
| B、2L 0.3mol/L Na2SO4溶液中含有Na+为0.6NA |
| C、27g铝完全反应后失去的电子数为3NA |
| D、11.2L氮气所含的分子数为0.5NA |
关于下列物质的说法,正确的是( )


| A、三者含有的官能团的种类相同 |
| B、乙和丙中的-OH性质相同 |
| C、甲和乙互为同分异构体 |
| D、甲和丙互为同分异构体 |
 环六次甲基四胺是一种重要的化工原料,其结构式如图所示.下列关于环六次甲基四胺分子结构的叙述中正确的是( )
环六次甲基四胺是一种重要的化工原料,其结构式如图所示.下列关于环六次甲基四胺分子结构的叙述中正确的是( )| A、分子中所有的N,C原子共面 |
| B、结构式中打*的N原子处于分子的中心 |
| C、分子中含有3个相同的C,N交替排列的六元环 |
| D、连接分子中的4个N原子可构成一个正四面体 |
下列化学用语正确的是( )
A、甲烷的比例饿模型 |
B、CCl4的电子式: |
C、P的原子结构示意图 |
D、乙烯的结构式: |
与NH4+具有相同电子总数和质子总数的是( )
| A、Na+ |
| B、F- |
| C、Ne |
| D、K+ |
下列物质不能使溴水褪色但能使KMnO4酸性溶液褪色的是( )
| A、乙烷 | B、丁烯 | C、苯 | D、乙苯 |
分析下表,下列选项中错误的是( )
| 化学式 | NH3?H2O | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7, K2=5.6×l0-11 |
| A、0.1mol?L-1 CH3COONa溶液显碱性,0.1mol?L-1 CH3COONH4溶液显中性 |
| B、等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大 |
| C、NaCN+H2O+CO2(少量)=HCN+NaHCO3 |
| D、上述3种等体积等pH的酸溶液,分别加水稀释后pH仍相等,则醋酸中加入水的体积最少 |
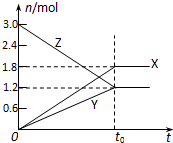 在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,t0时容器中达到化学平衡,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,t0时容器中达到化学平衡,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )| A、该反应的化学方程式为:3Z?3X+2Y |
| B、达到平衡时,X、Y、Z的质量不再改变 |
| C、达到平衡时,Z的浓度为1.2mol/L |
| D、达到平衡后,反应停止,反应速率为0 |