题目内容
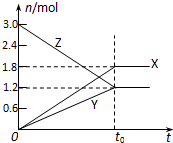 在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,t0时容器中达到化学平衡,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,t0时容器中达到化学平衡,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )| A、该反应的化学方程式为:3Z?3X+2Y |
| B、达到平衡时,X、Y、Z的质量不再改变 |
| C、达到平衡时,Z的浓度为1.2mol/L |
| D、达到平衡后,反应停止,反应速率为0 |
考点:物质的量或浓度随时间的变化曲线,化学平衡的计算
专题:化学平衡专题
分析:A、根据X、Y、Z物质的量的变化判断反应物、产物,利用物质的量之比等于化学计量数之比确定化学计量数,据此书写化学方程式;
B、化学平衡时的特征作判断;
C、根据物质的量与体积计算浓度;
D、根据可逆反应的特征判断.
B、化学平衡时的特征作判断;
C、根据物质的量与体积计算浓度;
D、根据可逆反应的特征判断.
解答:
解:A、由图可知,X、Y的物质的量增大,为生成物,Z物质的量减小,为反应物,到平衡后,X生成1.8mol,Y生成1.2mol,Z反应1.8mol,X、Y、Z的化学计量数之比=1.8:1.2:1.8=3:2:3,则反应的化学方程式为:3Z?3X+2Y,故A正确;
B、化学平衡时各组分的浓度不再随时间变化而变化,故X、Y、Z的质量也不再改变,故B正确;
C、根据图象可知平衡时Z的浓度为
=0.6mol/L,故C错误;
D、根据可逆反应平衡的特征可知,反应处于平衡时正逆反应速率相等,但不等于零,故D错误;
故选AB.
B、化学平衡时各组分的浓度不再随时间变化而变化,故X、Y、Z的质量也不再改变,故B正确;
C、根据图象可知平衡时Z的浓度为
| 1.2mol |
| 2L |
D、根据可逆反应平衡的特征可知,反应处于平衡时正逆反应速率相等,但不等于零,故D错误;
故选AB.
点评:本题考查了根据图象写化学方程式、计算浓度及运用化学平衡的特征解决问题,难度不大,主要是准确理解图象中有关信息.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
下列有关碱金属元素性质的叙述中,正确的是( )
| A、碱金属的单质中,锂的还原性最强 |
| B、K与水反应最剧烈 |
| C、在自然界中它们无游离态存在 |
| D、单质的熔沸点依次升高 |
新能源的开发利用是人类社会可持续发展的重要课题.下列属于新能源的是( )
| A、氢气 | B、煤炭 | C、天然气 | D、石油 |
法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也 有人称之为“零号元素”.下列有关“四中子”粒子的说法不正确的是( )
| A、该粒子不显电性 |
| B、与氢元素的质子数相同 |
| C、该粒子质量数为4 |
| D、该粒子质量比氢原子大 |
图示为一种天然产物,具有一定的除草功效.下列有关该化合物的说法错误的是( )
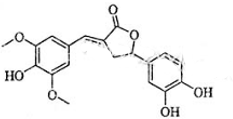

| A、分子含有三种含氧官能团 |
| B、1mol该化合物最多能与6mol NaOH反应 |
| C、既可以发生取代反应,又能够发生加成反应 |
| D、既能与FeCl3发生显色反应,也能与NaHCO3反应放出CO2 |
观察下列模型并结合有关信息,判断有关说法正确的是( )
| 硼晶体的结构单元 | SF6分子 | S8分子 | NaCl | |
| 结构模型示意图 |  |
 |
 |
 |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
| A、单质硼属分子晶体,其结构单元B12中含有30个B-B键,含20个正三角形 |
| B、SF6是由极性键构成的分子 |
| C、固态硫S8属于原子晶体 |
| D、NaCl熔化和溶于水均能产生自由移动的离子,且破坏的是同种作用力,NaCl晶胞中每个Na+周围最近且等距离的Na+有6个 |
有机化学知识在生活中应用广泛,下列说法正确的是( )
| A、乙二醇可用来生产聚酯纤维和作汽车发动机的抗冻剂 |
| B、乙醇是可再生能源,应大力推广“乙醇汽油”,含酒精的饮料中含有浓度不等的乙醇,75%(质量分数)的乙醇溶液常用于医疗消毒 |
| C、煤中含有煤焦油及多种化工原料,可通过煤的气化获得 |
D、据环保部门调查,2013年末,造成杭州自来水异味的元凶为邻叔丁基苯酚: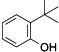 ,饮用含有该物质的水,对人体健康无任何不利影响 ,饮用含有该物质的水,对人体健康无任何不利影响 |
CO2、BF3、CCl4都是非极性分子,NH3、H2S都是极性分子,由此推出ABn型分子是非极性分子的经验规律,正确的是( )
| A、所有原子在同一平面内 |
| B、分子中不含有氢原子 |
| C、A的化合价的数值等于其最外层电子数 |
| D、分子结构对称 |