题目内容
8.下列溶液中物质的量浓度为1mol•L-1的是( )| A. | 将250 g CuSO4•5H2O溶解在1 L水中 | |
| B. | 将22.4 L HCl气体溶于水配成1 L溶液 | |
| C. | 将1 L 10 mol•L-1的浓盐酸加入9 L水中 | |
| D. | 将10 g NaOH溶解在少量水中,再加蒸馏水到溶液体积为250 mL |
分析 根据n=$\frac{m}{M}$、c=$\frac{n}{V}$计算,注意溶液的体积不等于水的体积.
解答 解:A.溶液的体积不等于水的体积,水为1L时,无法确定溶液的体积,故A错误;
B.没有说明是否是标准状况,所以无法计算气体的物质的量,故B错误;
C.溶液的体积无法确定,不能根据c=$\frac{n}{V}$计算,故C错误;
D.将10 g NaOH溶解在少量水中,再加蒸馏水到溶液体积为250 mL,则物质的量浓度为$\frac{\frac{10g}{40g/mol}}{0.25L}$=1mol/L,故D正确.
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意钠离子的浓度与溶液体积大小无关,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案
相关题目
18.下列固体加热熔化时需破坏非极性共价键的是( )
| A. | 碘单质 | B. | 金刚石 | C. | 二氧化硅 | D. | 氢氧化钠 |
3.下列物质的水溶液中存在溶质分子的是( )
| A. | HCl | B. | NaHCO3 | C. | 蔗糖 | D. | NaOH |
13.已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量;②1molCl2分子中化学键断裂时需要吸收243kJ的能量;③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量.下列叙述正确的是( )
| A. | 氢气和氯气反应生成氯化氢气体的热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ | |
| B. | 氢气与氯气反应生成4.48L氯化氢气体,反应的△H=-183kJ/mol | |
| C. | 氢气与氯气反应生成2mol氯化氢气体,反应的△H=+183kJ/mol | |
| D. | 氢气与氯气反应生成氯化氢气体放出183KJ的热量时,转移电子物质的量为2 mol |
17.下列可被工业上采用的冶金方法是( )
| A. | 电解熔融的氯化铝制铝 | B. | 电解熔融的氯化镁制镁 | ||
| C. | 电解氯化钠溶液制钠 | D. | 高温下用H2还原氧化镁制镁 |
18.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A. | 分子总数为NA的SO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 1 L 1 mol/L NaCl溶液含有NA个Na+ | |
| C. | 常温常压下,96 g的O2和O3混合气体含有的原子数为6NA | |
| D. | 常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA |


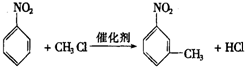 .
.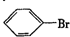 .
. ”中的反应中属于取代反应的是ab,属于加成反应的是c(填字母).
”中的反应中属于取代反应的是ab,属于加成反应的是c(填字母). 的所有原子不是(填“是”或“不是”)在同一平面上.
的所有原子不是(填“是”或“不是”)在同一平面上.