题目内容
3.下列各组物质中,常温下发生反应并放出红棕色气体的是( )| A. | 铜和浓硫酸 | B. | 铜和浓硝酸 | C. | 铜和浓盐酸 | D. | 铁和稀硫酸 |
分析 常温下Cu与浓硝酸反应生成红棕色气体二氧化氮,以此来解答.
解答 解:A.常温下Cu与浓硫酸不反应,加热反应生成无色气体二氧化硫,故A不选;
B.常温下Cu与浓硝酸反应生成红棕色气体二氧化氮,故B选;
C.常温下Cu与浓盐酸不反应,故C不选;
D.常温下铁与稀硫酸反应生成无色气体氢气,故D不选;
故选B.
点评 本题考查物质的性质,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
16.下列有关说法正确的是( )
| A. | 铁是活泼金属,铁器不能盛装所有酸 | |
| B. | 硫酸铁具有氧化性,它可用于自来水净化和消毒 | |
| C. | 铁具有延展性,可以用铁丝替代铝材料作导线 | |
| D. | 铁红常用于制作红色颜料 |
11.在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3;②Fe2O3;③Cu(NO3)2;④KNO3,铜粉溶解的是( )
| A. | 只有①或② | B. | 只有②或④ | ||
| C. | 只有①或②或③ | D. | 上述四种物质中任意一种 |
18.检验某溶液中是否含有 K+、Fe3+、Cl-、Mg2+、I-、CO32-、SO42-,限用的试剂有:盐酸、硫酸、硝酸银溶液、硝酸钡溶液.设计如下实验步骤,并记录相关现象.下列叙述不正确的是( )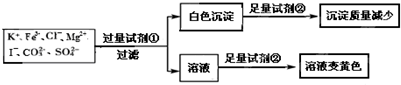

| A. | 试剂①为硝酸钡 | |
| B. | 试剂②一定为盐酸 | |
| C. | 该溶液中一定有 I-、CO32-、SO42-、K+ | |
| D. | 通过在黄色溶液中加入硝酸银溶液可以检验原溶液中是否存在Cl- |
8.下列实验中均需要的仪器是( )
①蒸发 ②配制溶液 ③过滤.
①蒸发 ②配制溶液 ③过滤.
| A. | 试管 | B. | 玻璃棒 | C. | 胶头滴管 | D. | 漏斗 |
12.短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下表:
(1)XY2的电子式是 ;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.
;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.
(2)X的非金属性比M强(填“强”或“弱”),能证明此结论的事实是CO2+H2O+SiO32-=H2SiO3↓+CO32-或2CO2+2H2O+SiO32-=H2SiO3↓+2HCO3-(用离子方程式表示).
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 ;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.
;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.(2)X的非金属性比M强(填“强”或“弱”),能证明此结论的事实是CO2+H2O+SiO32-=H2SiO3↓+CO32-或2CO2+2H2O+SiO32-=H2SiO3↓+2HCO3-(用离子方程式表示).
13.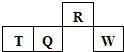 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R<Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | 含T的盐T可以出现在酸根中 |
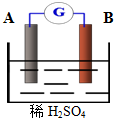 如图为原电池装置:
如图为原电池装置: