题目内容
16.下列有关说法正确的是( )| A. | 铁是活泼金属,铁器不能盛装所有酸 | |
| B. | 硫酸铁具有氧化性,它可用于自来水净化和消毒 | |
| C. | 铁具有延展性,可以用铁丝替代铝材料作导线 | |
| D. | 铁红常用于制作红色颜料 |
分析 A.常温下铁、铝在浓硫酸、浓硝酸中发生钝化,可以盛放运输;
B.硫酸铁溶液中铁离子水解生成氢氧化铁胶体,具有吸附悬浮杂质的作用;
C.铁丝中含较多杂质,电阻越大,电的损耗越大;
D.铁红的成分是氧化铁,是红棕色的固体.
解答 解:A.铁是活泼金属,常温下铁在浓硫酸中发生钝化,阻止反应进行,铁器能盛装浓硫酸,铁和稀硫酸反应不能盛放,故A错误;
B.硫酸铁溶液中铁离子水解生成氢氧化铁胶体,具有吸附悬浮杂质的作用,但不能消毒,故B错误;
C.普通金属铁里,铁因为电阻大,又易氧化(生锈),极易发生事故,故而一般不用,故C错误;
D.氧化铁是红棕色的固体,常用于制造红色油漆和涂料,故D正确;
故选D.
点评 本考考查了常见物质的性质和用途,体现了性质决定用途,用途反映性质的理念,属于基础知识的考查,题目难度不大,要加强记忆.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
7.(CN)2、(SCN)2、(OCN)2称“类卤素”,与卤素单质的性质相似,而其阴离子性质也相似,如:2Fe+3(SCN)2═2Fe(SCN)3,2Fe+3Cl2═2FeCl3.以此判断下列化学方程式中错误的是( )
| A. | (CN)2+H2O?HCN+HCNO | |
| B. | (SCN)2+2Cu$\frac{\underline{\;\;△\;\;}}{\;}$ 2CuSCN | |
| C. | (OCN)2+2NaOH═NaOCN+NaOCNO+H2O | |
| D. | MnO2+4HSCN(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ (SCN)2↑+Mn(SCN)2+2H2O |
4.下列各组物质中,前者是纯净物,后者是混合物的是( )
| A. | 水煤气 漂白粉 | B. | 盐酸 硫酸钡 | ||
| C. | 硫酸铜晶体 铝热剂 | D. | 玻璃 含铁70%的氧化铁 |
11.次氯酸的电子式为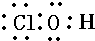 ,则1mol该物质所含有的电子的物质的量是( )
,则1mol该物质所含有的电子的物质的量是( )
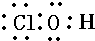 ,则1mol该物质所含有的电子的物质的量是( )
,则1mol该物质所含有的电子的物质的量是( )| A. | 14mol | B. | 15mol | C. | 26mol | D. | 27mol |
3.下列各组物质中,常温下发生反应并放出红棕色气体的是( )
| A. | 铜和浓硫酸 | B. | 铜和浓硝酸 | C. | 铜和浓盐酸 | D. | 铁和稀硫酸 |
4.在100℃时,将0.200mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如表:
试填空:
(1)该反应的化学方程式为N2O4?2NO2,达到平衡时四氧化二氮的转化率为60%%.
(2)20s时四氧化二氮的浓度c1=0.07mol•L-1,在0~20s时间段内,四氧化二氮的平均反应速率为0.0015mol•L-1•s-1.
| 时间 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | 0.040 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)该反应的化学方程式为N2O4?2NO2,达到平衡时四氧化二氮的转化率为60%%.
(2)20s时四氧化二氮的浓度c1=0.07mol•L-1,在0~20s时间段内,四氧化二氮的平均反应速率为0.0015mol•L-1•s-1.