题目内容
15. 氨在国民经济中占有重要地位,具有广泛的用途.
氨在国民经济中占有重要地位,具有广泛的用途.(1)氯胺(NH2Cl)消毒法具有效率高、成本低的优点,因此在用液氯处理自来水的同时会通入少量氨气产生氯胺,反应为:
Cl2+NH3=NH2Cl+HCl.
①NH2Cl是共价化合物,其结构式是
 .
.②利用NH2Cl部分水解生成的 HClO起到消毒杀菌的作用,该水解方程式是NH2Cl+H2O?HClO+NH3或NH2Cl+2H2O?HClO+NH3•H2O.
(2)Ⅰ.在一定条件下,工业上用氨气制尿素的反应为:2NH3(g)+CO2(g)CO(NH2)2(g)+H2O(g).
在一定温度下,向2L某恒容密闭容器中充入4molNH3(g)和1molCO2(g),5min时,测得容器中混合气体总的物质的量为 4.5mol.
①0~5min 内,用 NH3表示的平均反应速率υ(NH3)=0.0.1mol/(L•min).
②下列说法中能判断该反应达到平衡状态的是ac.
a.单位时间内生成nmol H2O同时生成2n mol NH3
b.CO(NH 2)2、H2O的物质的量浓度之比1:1
c.容器内压强保持不变
d.混合气体的密度不变
Ⅱ.人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图所示.
①%2b 为电源的负极.
②A 室中电极上发生的反应是2Cl--2e-=Cl2↑,A 室中除去尿素的化学方程式是3Cl2+CO(NH2)2+H2O=N2+6HCl+CO2.
分析 (1)①NH2Cl是共价化合物,其结构式是 ;
;
②利用NH2Cl部分水解生成的 HClO起到消毒杀菌的作用和氨气或一水合氨,所以水解方程式是NH2Cl+H2O?HClO+NH3或NH2Cl+2H2O?HClO+NH3•H2O;
(2)Ⅰ.①平均反应速率v(NH3)=$\frac{△c}{△t}$,据此计算即可;
②根据化学平衡状态的标志:正反应速率等于逆反应速率,平衡混合物中各组成成分的含量不变来判断;
Ⅱ.人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图所示.
①氢离子发生还原反应,为负极;
②A 室为阳极,发生氧化反应,氯离子放电生成氯气,电极上发生的反应是2Cl--2e-=Cl2↑,A 室中除去尿素的化学方程式是3Cl2+CO(NH2)2+H2O=N2+6HCl+CO2.
解答 解:(1)①NH2Cl是共价化合物,其结构式是 ,故答案为:
,故答案为: ;
;
②利用NH2Cl部分水解生成的 HClO起到消毒杀菌的作用和氨气或一水合氨,所以水解方程式是NH2Cl+H2O?HClO+NH3或NH2Cl+2H2O?HClO+NH3•H2O,故答案为:NH2Cl+H2O?HClO+NH3或NH2Cl+2H2O?HClO+NH3•H2O;
(2)Ⅰ.①2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)的物质的量的减少量为:1+4-4.5=0.5mol,而物质的量的减少量等于氨气的变化的一半,所以v(NH3)=$\frac{△c}{△t}$=$\frac{\frac{0.5×2mol}{2L}}{5min}$=0.0.1mol/(L•min),故答案为:0.0.1mol/(L•min);
②a.单位时间内生成nmol H2O等效于消耗2n mol NH3同时生成2n mol NH3,正逆反应速率相等,故正确;
b.CO(NH 2)2、H2O的物质的量浓度之比1:1,而不是不变的状态,故错误;
c.容器内压强保持不变,说明各物质的物质的量不变,反应达平衡状态,故正确;
d.混合气体的密度始终不变,故错误;
故选:a c;
Ⅱ.①①氢离子发生还原反应,为负极,故答案为:负;
②A 室为阳极,发生氧化反应,氯离子放电生成氯气,电极上发生的反应是2Cl--2e-=Cl2↑,A 室中除去尿素的化学方程式是3Cl2+CO(NH2)2+H2O=N2+6HCl+CO2,故答案为:2Cl--2e-=Cl2↑;3Cl2+CO(NH2)2+H2O=N2+6HCl+CO2.
点评 本题涉及结构式、化学反应速率和平衡移动原理的应用、平衡状态的判断等方面的知识,属于综合知识的考查,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 新制氯水中只含Cl2和H2O 分子 | |
| B. | 新制氯水可使蓝色石蕊试纸变红且不褪色 | |
| C. | 光照氯水有气泡逸出,该气体是Cl2 | |
| D. | 氯水放置数天后酸性将变强 |
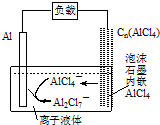 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl7-+Cl- | |
| B. | 放电时,电路中每流过3mol电子,正极减少27g | |
| C. | 充电时,泡沫石墨极与外电源的负极相连 | |
| D. | 充电时,阴极发生:4Al2Cl7-+3e-=Al+7AlCl4- |
| A. | 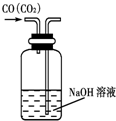 除去CO气体中的CO2气体 | B. |  分 分离碘酒中的碘和酒精 | ||
| C. | 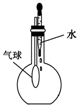 验证NH3的溶解性 | D. | 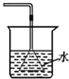 吸收HCl防倒吸 |
 在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)?2SO3(g)△H<0的影响如图所示,下列说法正确的是( )
在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)?2SO3(g)△H<0的影响如图所示,下列说法正确的是( )| A. | 反应b、c点均为平衡点,a点未达平衡且向正反应方向进行 | |
| B. | a、b、c三点的平衡常数Kb>Kc>Ka | |
| C. | 上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高 | |
| D. | a、b、c三点中,a点时SO2的转化率最高 |
| A. | 标准状况下,5.6 LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| B. | 78 g苯含有C=C双键的数目为3 NA | |
| C. | 1 L1mol•L-1的CuSO4溶液中含NA个Cu2+ | |
| D. | 常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3NA |
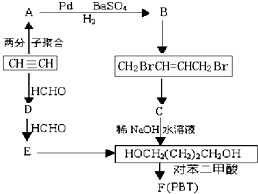 请根据以下知识解答
请根据以下知识解答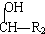 (R代表烃基,下同.)
(R代表烃基,下同.)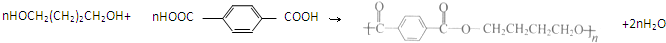 .
. .
.