题目内容
4.中和10%的硫酸溶液49g,需要氢氧化钠多少摩尔?反应后盐溶液的质量分数是多少?分析 发生反应为2NaOH+H2SO4═Na2SO4+2H2O,根据硫酸溶液的质量及质量分数计算出含有硫酸的质量,再计算出硫酸的物质的量,然后利用反应方程式计算出消耗氢氧化钠的物质的量和生成硫酸钠的物质的量;最后根据溶质质量分数表达式计算出反应后硫酸钠的质量分数.
解答 解:49g 10%的硫酸溶液中含有硫酸的物质的量为:$\frac{49g×10%}{98g/mol}$=0.05mol,根据反应2NaOH+H2SO4═Na2SO4+2H2O可知,中和0.05mol硫酸消耗NaOH的物质的量为:0.05mol×0.1mol;
0.05mol硫酸完全反应生成0.05mol硫酸钠,其质量为:142g/mol×0.05mol=7.1g,反应后溶液质量为:49g+40g/mol×0.1mol=53g,则反应后盐溶液的质量分数为:$\frac{7.1g}{53g}$×100%≈14.3%,
答:中和该硫酸需要消耗0.1mol氢氧化钠;反应后硫酸钠的质量分数为14.3%.
点评 本题考查了溶质质量分数的计算,题目难度不大,明确发生反应的原理为解答关键,注意掌握质量分数的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
14.FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1:1:1时,实际参加反应的FeS与HNO3的物质的量之比为( )
| A. | 1:6 | B. | 2:15 | C. | 2:11 | D. | 1:7 |
19.下列说法正确的是( )
| A. | 物质的量就是物质的质量 | |
| B. | 氧气的摩尔质量为32g | |
| C. | 摩尔是国际单位制的七大基本物理量之一 | |
| D. | 同温同压下,分子数相同的任何气体体积相同 |
9.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol/L NH4HCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/LHCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )>c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
7.下列关于Na2CO3和NaHCO3性质的说法中,正确的是( )
| A. | 常温时在水中的溶解性:NaHCO3>Na2CO3 | |
| B. | 热稳定性:NaHCO3<Na2CO3 | |
| C. | 与酸反应的快慢:NaHCO3<Na2CO3 | |
| D. | Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3 |
 氨在国民经济中占有重要地位,具有广泛的用途.
氨在国民经济中占有重要地位,具有广泛的用途. .
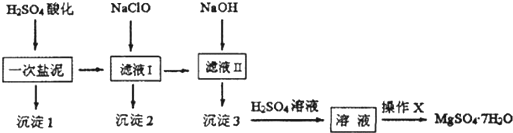
.
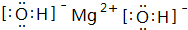 (写电子式).
(写电子式).