题目内容
海藻中含有丰富的、以各种无机盐形式存在的碘元素,下图是实验室从海藻里提取碘的流程的一部分.下列判断正确的是( )
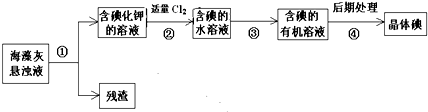

| A、步骤①、③、④的操作分别是过滤、萃取、分液 |
| B、可用淀粉溶液检验步骤②的反应是否进行完全 |
| C、步骤③中加入的有机溶剂是汽油或酒精 |
| D、步骤②之后的碘均为游离态 |
考点:海水资源及其综合利用
专题:元素及其化合物,化学实验基本操作
分析:A.难溶性固体和溶液采用过滤的方法分离;同一溶质在不同溶剂中的溶解度不同的溶质可以采用萃取的方法分离;互不相溶的液体采用分液的方法分离;
B.淀粉能检验碘单质不能检验碘离子;
C.萃取剂和原溶剂不能互溶;
D.碘离子完全被氧化生成碘单质.
B.淀粉能检验碘单质不能检验碘离子;
C.萃取剂和原溶剂不能互溶;
D.碘离子完全被氧化生成碘单质.
解答:
解:A.步骤①、③、④的操作分别是过滤、萃取、蒸馏,故A错误;
B.碘遇淀粉试液变蓝色,淀粉能检验碘单质不能检验碘离子,故B错误;
C.萃取剂和原溶剂不能互溶,酒精和水互溶,所以不能作萃取剂,故C错误;
D.碘离子完全被氧化生成碘单质,反应方程式为2I-+Cl2=2Cl-+I2,故D正确;
故选D.
B.碘遇淀粉试液变蓝色,淀粉能检验碘单质不能检验碘离子,故B错误;
C.萃取剂和原溶剂不能互溶,酒精和水互溶,所以不能作萃取剂,故C错误;
D.碘离子完全被氧化生成碘单质,反应方程式为2I-+Cl2=2Cl-+I2,故D正确;
故选D.
点评:本题考查了海水资源的综合利用,明确物质分离提纯的选取方法、萃取剂的选取标准、每一步发生的反应即可解答,题目难度不大.

练习册系列答案
相关题目
在盛放酒精的试剂瓶的标签上应印有的警示标志是( )
A、 |
B、 |
C、 |
D、 |
一定温度下,在密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,反应达到平衡时,下列说法不正确的是( )
| A、若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深 |
| B、若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物质的百分含量不变 |
| C、若体积不变,向容器中再加入一定量的N2O4,平衡向逆反应方向移动,再次平衡时N2O4的转化率将降低 |
| D、若体积不变,升高温度,再次平衡时体系颜色加深 |
某温度和压强下,将4g由三种炔烃组成的混合气体与足量的氢气反应,充分加成后,生成4.4g三种对应的烷烃,则所得烷烃中一定有( )
| A、异丁烷 | B、乙烷 | C、丙烷 | D、丁烷 |
在周期表中,最可能处于同一族的是( )
| A、Q和R | B、S和T |
| C、T和U | D、R和U |
分离 FeCl3、KCl、CaCO3的固体混合物,应采用的一组试剂是( )
| A、水、硝酸银、稀硝酸 |
| B、水、氢氧化钠、盐酸 |
| C、水、氢氧化钾、盐酸 |
| D、水、氢氧化钾、硫酸 |
下列说法正确的是( )
| A、硫粉在过量的氧气中燃烧可以生成SO3 |
| B、可以用澄清石灰水鉴别CO2和SO2 |
| C、将少量CO2通入BaCl2溶液能生成白色沉淀 |
| D、不能用排水法收集SO2、NO2气体 |
已知断裂1mol C-H键,要吸收热量414.4kJ;断裂1mol C-C键,要吸收热量347.4kJ;生成1mol C═C键,会放出热量615.3kJ;生成1mol H-H键,会放出热量435.3kJ,某有机物分解的反应可表示为:
若在反应中消耗了1mol乙烷,则有关该反应的说法正确的是( )

若在反应中消耗了1mol乙烷,则有关该反应的说法正确的是( )
| A、该反应放出251.2 kJ的热量 |
| B、该反应吸收251.2 kJ的热量 |
| C、该反应放出125.6 kJ的热量 |
| D、该反应吸收125.6 kJ的热量 |