题目内容
在周期表中,最可能处于同一族的是( )
| A、Q和R | B、S和T |
| C、T和U | D、R和U |
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3.
解答:
解:由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3,所以R和U的第一至第四电离能变化规律相似,即R和U最可能在同一主族.
故选D.
故选D.
点评:本题考查电离能知识,题目难度中等,注意原子的最外层电子数与电离能以及化合价的关系.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
下列说法正确的是( )
| A、需要加热的反应一定是吸热反应 |
| B、所有的化学反应都有能量变化 |
| C、所有的放热反应都可以在常温常压下自发进行 |
| D、核能作为一种反应热,是理想的新能源 |
 某微观模型如图所示,则下列说法正确的是( )
某微观模型如图所示,则下列说法正确的是( )| A、若该模型为一种气态团簇分子,则其分子式为A13B14 | ||
| B、若该模型为某离子晶体的晶胞,则该晶体的化学式为A4B4 | ||
C、若该模型为某纳米材料的颗粒,则该颗粒表面粒子占粒子总数的
| ||
| D、若该模型为某晶体的晶胞,晶胞中B原子位于最近且等距离A原子围成的正四面体空隙中心 |
海藻中含有丰富的、以各种无机盐形式存在的碘元素,下图是实验室从海藻里提取碘的流程的一部分.下列判断正确的是( )
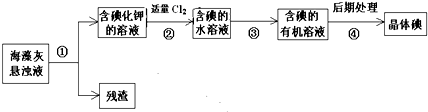

| A、步骤①、③、④的操作分别是过滤、萃取、分液 |
| B、可用淀粉溶液检验步骤②的反应是否进行完全 |
| C、步骤③中加入的有机溶剂是汽油或酒精 |
| D、步骤②之后的碘均为游离态 |
已知1.2g C(石墨)不完全燃烧生成CO,放出11.1kJ热量,继续燃烧又放出28.3kJ热量.则能表示C(石墨)燃烧热的热化学方程式为( )
A、C(石墨 s)+
| ||
B、C(石墨 s)+
| ||
| C、C(石墨 s)+O2(g)=CO2(g)△H=-394kJ?mol-1 | ||
| D、C(石墨 s)+O2(g)=CO2(g)△H=-283kJ?mol-1 |
向装有碘水的试管中加CCl4振荡,静置后,你观察到的现象是( )
| A、上层几乎无色,下层紫红色 |
| B、上层紫红色,下层几乎无色 |
| C、上层几乎无色,下层橙色 |
| D、不分层,紫红色 |
有关晶体的结构如下图所示,下列说法中不正确的是( )
A、 在NaCl晶体中,距Na+最近的Cl-形成正八面体 |
B、 在CaF2晶体中,每个晶胞平均占有4个Ca2+ |
C、 在金刚石晶体中,碳原子与碳碳键个数的比为1:4 |
D、 铜晶体为面心立方堆积,铜原子的配位数为12 |
不能用于判断HA是弱电解质(弱酸)的依据是( )
| A、浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多 |
| B、pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多 |
| C、浓度相等的HCl与HA两溶液,c(H+)HCl约是c(H+)HA的100倍 |
| D、pH相等的HCl与HA两溶液,c(HA)约是c(HCl)的100倍 |