题目内容
(1)如何制备Fe(OH)3胶体?请写出操作要求及反应方程式: ,怎样用实验证明形成了胶体 .
(2)在Fe(OH)3胶体中逐渐滴入HI稀溶液,会出现一系列变化.
①先出现红色沉淀,原因是 .
②随后沉淀溶解,溶液呈黄色,此反应的离子方程式是 .
③最后溶液颜色加深,原因是 ,此反应的离子方程式是 .
④若用稀盐酸代替HI稀溶液,能出现上述相同变化现象的是 .
(2)在Fe(OH)3胶体中逐渐滴入HI稀溶液,会出现一系列变化.
①先出现红色沉淀,原因是
②随后沉淀溶解,溶液呈黄色,此反应的离子方程式是
③最后溶液颜色加深,原因是
④若用稀盐酸代替HI稀溶液,能出现上述相同变化现象的是
考点:胶体的重要性质
专题:溶液和胶体专题
分析:(1)氢氧化铁胶体制备原理:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl;操作:向沸腾的蒸馏水中逐滴加入1~2mL饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热;胶体特征能够发生丁达尔效应,可以用丁达尔效应证明胶体的存在;
(2)氢氧化铁胶体加可溶性电解质HI稀溶液发生聚沉产生氢氧化铁沉淀,继续滴加,发生酸碱中和反应,沉淀溶解溶液呈黄色,溶液中的三价铁离子具有强的氧化性,将碘离子氧化成单质碘,颜色变身;用稀盐酸代替HI稀溶液,氢氧化铁胶体先发生聚沉,产生氢氧化铁沉淀,然后发生酸碱中和反应,沉淀溶解.
(2)氢氧化铁胶体加可溶性电解质HI稀溶液发生聚沉产生氢氧化铁沉淀,继续滴加,发生酸碱中和反应,沉淀溶解溶液呈黄色,溶液中的三价铁离子具有强的氧化性,将碘离子氧化成单质碘,颜色变身;用稀盐酸代替HI稀溶液,氢氧化铁胶体先发生聚沉,产生氢氧化铁沉淀,然后发生酸碱中和反应,沉淀溶解.
解答:
解:(1)氢氧化铁胶体制备原理:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl,操作:向沸腾的蒸馏水中逐滴加入1~2mL饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热;丁达尔效应是胶体的特征性质,所以可以借助丁达尔效应证明胶体的存在;
故答案为:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl,操作:向沸腾的蒸馏水中逐滴加入1~2mL饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热;当一束光线透过胶体,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路”;
(2)①HI稀溶液可溶性是电解质,加入到氢氧化铁胶体中使胶体发生聚沉,
故答案为:加入可溶性电解质使胶体聚沉;
②随后沉淀溶解,溶液呈黄色,是因为氢氧化铁沉淀与HI稀溶液发生酸碱中和反应,离子方程式为:Fe(OH)3+3H+═Fe3++3H2O,
故答案为:Fe(OH)3+3H+═Fe3++3H2O;
③最后溶液颜色加深是因为Fe3+与 HI稀溶液中的I-发生氧化还原反应生成单质I2的水溶液,反应的离子方程式为:2Fe3++2I-═2Fe2++I2,
故答案为:生成了单质I2 2Fe3++2I-═2Fe2++I2;
④稀盐酸滴加到氢氧化铁胶体中,先发生聚沉,然后发生酸碱中和,现象是:先出现红色沉淀,随后沉淀溶解,溶液呈黄色,
故答案为:先出现红色沉淀,随后沉淀溶解,溶液呈黄色.
故答案为:FeCl3+3H2O=Fe(OH)3(胶体)+3HCl,操作:向沸腾的蒸馏水中逐滴加入1~2mL饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热;当一束光线透过胶体,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路”;
(2)①HI稀溶液可溶性是电解质,加入到氢氧化铁胶体中使胶体发生聚沉,
故答案为:加入可溶性电解质使胶体聚沉;
②随后沉淀溶解,溶液呈黄色,是因为氢氧化铁沉淀与HI稀溶液发生酸碱中和反应,离子方程式为:Fe(OH)3+3H+═Fe3++3H2O,
故答案为:Fe(OH)3+3H+═Fe3++3H2O;
③最后溶液颜色加深是因为Fe3+与 HI稀溶液中的I-发生氧化还原反应生成单质I2的水溶液,反应的离子方程式为:2Fe3++2I-═2Fe2++I2,
故答案为:生成了单质I2 2Fe3++2I-═2Fe2++I2;
④稀盐酸滴加到氢氧化铁胶体中,先发生聚沉,然后发生酸碱中和,现象是:先出现红色沉淀,随后沉淀溶解,溶液呈黄色,
故答案为:先出现红色沉淀,随后沉淀溶解,溶液呈黄色.
点评:本题考查了胶体的性质和制备,题目难度不大,注意HI溶液中I-的还原性.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
下列叙述正确的是( )
| A、某元素由化合态变成游离态,该元素一定被氧化 |
| B、卤素离子(X-)只有还原性而无氧化性 |
| C、失电子难的原子获得电子的能力一定强 |
| D、负一价卤素离子的还原性在同一族中从上至下逐渐增强 |
下列化学反应方程式或离子方程式书写正确的是( )
| A、乙烯制溴乙烷:CH2CH2+Br2→CH2BrCH2Br | |||
B、乙醇催化氧化:2CH3CH2OH+O2
| |||
C、苯与氢气加成: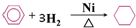 | |||
| D、从海带中提取碘:H2O2+2I-+2H+=I2+2H2O |
下列有关反应的离子方程式的书写中,不正确的是( )
| A、小苏打与氢氧化钠溶液混合:HCO3-+OH-═CO32-+H2O |
| B、向溴化亚铁溶液中通入少量的Cl2:Cl2+2Br-═2Cl-+Br2 |
| C、向新制氯水中滴加NaOH溶液后,黄绿色褪去:Cl2+2OH-═ClO-+Cl-+H2O |
| D、将鸡蛋壳浸泡在盐酸中:CaCO3+2H+═Ca2++CO2+H2O |
 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
 .已知有机物中若含有相同的官能团,则化学性质相似.完成下列问题:
.已知有机物中若含有相同的官能团,则化学性质相似.完成下列问题:
 某化学兴趣小组的同学用如图装置研究电化学的问题.
某化学兴趣小组的同学用如图装置研究电化学的问题.