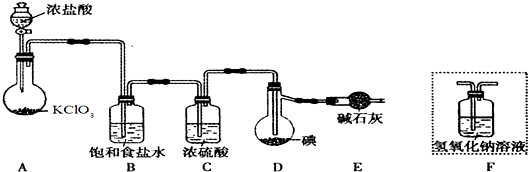
题目内容
铝是常见的轻金属,它能发生下列变化:

试回答:
(1)上述变化中,具有两性的化合物是 (填化学式)
(2)上述变化中,X是 ,Y是 (填化学式)
(3)写出A→C的离子方程式: .

试回答:
(1)上述变化中,具有两性的化合物是
(2)上述变化中,X是
(3)写出A→C的离子方程式:
考点:无机物的推断
专题:
分析:铝既可与强酸反应,也可与强碱反应,铝与盐酸反应生成的A为AlCl3,因Al(OH)3可溶于强碱,而A与过量Y反应生成沉淀,说明Y为弱碱,一般为氨水,C为Al(OH)3,D为Al2O3,X也能与Al反应,应为强碱,一般为NaOH,B为NaAlO2,以此解答该题.
解答:
解:铝既可与强酸反应,也可与强碱反应,铝与盐酸反应生成的A为AlCl3,因Al(OH)3可溶于强碱,而A与过量Y反应生成沉淀,说明Y为弱碱,一般为氨水,C为Al(OH)3,D为Al2O3,X也能与Al反应,应为强碱,一般为NaOH,B为NaAlO2,
(1)题目涉及两性的化合物有Al(OH)3、Al2O3,故答案为:Al(OH)3、Al2O3;
(2)由以上分析可知X为NaOH,Y为NH3,故答案为:NaOH;NH3;
(3)A为AlCl3,C为Al(OH)3,A→C的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
(1)题目涉及两性的化合物有Al(OH)3、Al2O3,故答案为:Al(OH)3、Al2O3;
(2)由以上分析可知X为NaOH,Y为NH3,故答案为:NaOH;NH3;
(3)A为AlCl3,C为Al(OH)3,A→C的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
点评:本题考查无机物的推断,为高频考点,侧重学生的分析能力和元素化合物知识的综合理解和运用的考查,本题着重于铝以及化合物的考查,主要把握相关物质的性质,难度不大.

练习册系列答案
相关题目
将Na2CO3?10H2O和NaHCO3的混合物11.94g,溶于水配制成200mL溶液,测得溶液中Na+浓度为0.5mol/L.若将11.94g该混合物加热至质量不再改变时,得到的固体物质的质量为( )
| A、1.06 g |
| B、3.1 g |
| C、5.3 g |
| D、9.0 g |
关于食物的酸碱性,下列说法不正确的是( )
| A、食物的酸碱性是按食物在体内代谢最终产物的性质来分类的 |
| B、由碳、氮、硫、磷等元素组成的蛋白质是酸性食物 |
| C、蔬菜、水果多含钾、钠、钙、镁等盐类,习惯称为碱性食物 |
| D、柠檬酸属于酸性食物 |
有关离子浓度大小比较的判断正确的是( )
| A、常温下NaB溶液的pH=8,c(Na+)-c(B-)=1×10-2 mol/L |
| B、Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、KHSO3溶液呈酸性,c(K+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) |
| D、0.1mol?L-1 NH4Cl和0.1mol?L-1 NH3?H2O等体积混合后溶液呈碱性:c(NH3?H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
下列说法正确的是( )
| A、2-二甲基-2-溴丁烷发生消去反应后的生成物不存在同分异构体 |
| B、在CH3-CH=CH-C≡C-CF3分子中,6个碳原子一定不在同一平面上 |
| C、由2-氯丙烷制取1,2-丙二醇时,需要经过取代→消去→加成三步反应完成 |
| D、将铜丝在酒精灯火焰上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
下列物质间的转化关系中,M不能为( )
M
氧化物
酸或碱
盐.
M
| O2 |
| H2O |
| +NaOH或HCl |
| A、钠 | B、氮气 | C、木炭 | D、硫 |