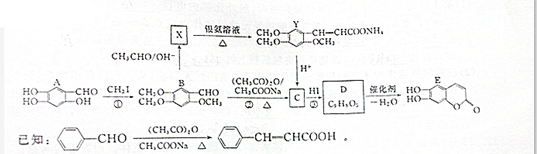
题目内容
已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:ICl(l)+Cl2(g)═ICl3(l)
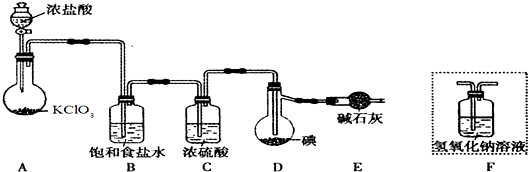
(1)装置A中发生反应的化学方程式是 .
(2)装置B的作用是 .不能用装置F代替装置E,理由 .
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是 (填标号).
A.过滤 B.蒸发结晶 C.蒸馏 D.分液
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度.进行如下两个实验,实验过程中有关反应为:
①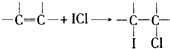
②ICl+KI═I2+KCl
③I2+2Na2S2O3═2NaI+Na2S4O6
实验1:将5.00g该油脂样品溶于四氯化碳后形成100mL溶液,从中取出十分之一,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol?L-1的Na2S2O3标准溶液滴定.经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL.
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL.
①滴定过程中可用 作指示剂.
②滴定过程中需要不断振荡,否则会导致V1 (填“偏大”或“偏小).
③5.00g该油脂样品所消耗的ICl的物质的量为 mol.由此数据经换算即可求得该油脂的不饱和度.

(1)装置A中发生反应的化学方程式是
(2)装置B的作用是
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是
A.过滤 B.蒸发结晶 C.蒸馏 D.分液
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度.进行如下两个实验,实验过程中有关反应为:
①
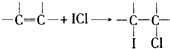
②ICl+KI═I2+KCl
③I2+2Na2S2O3═2NaI+Na2S4O6
实验1:将5.00g该油脂样品溶于四氯化碳后形成100mL溶液,从中取出十分之一,加人20mL某ICl的冰醋酸溶液(过量),充分反应后,加人足量KI溶液,生成的碘单质用a mol?L-1的Na2S2O3标准溶液滴定.经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL.
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL.
①滴定过程中可用
②滴定过程中需要不断振荡,否则会导致V1
③5.00g该油脂样品所消耗的ICl的物质的量为
考点:制备实验方案的设计,氯、溴、碘及其化合物的综合应用,探究物质的组成或测量物质的含量
专题:实验题,卤族元素
分析:(1)氯酸钾具有氧化性能把浓盐酸氧化生成氯气;
(2)制备的氯气中含有氯化氢,可以用饱和食盐水除去氯气中的氯化氢;装置F中的水蒸气进入装置D中,会使ICl水解;
(3)ICl与ICl3的沸点相差较大;
(4)①碘遇淀粉显蓝色;
②滴定过程中需要不断振荡,如果不振荡,则单质碘不能完全反应;
③实验2中比实验1多消耗的溶液体积为(V2-V1)ml,其物质的量的是0.001a(V2-V1)mol,
根据方程式②ICl+KI=I2+KCl和③I2+2Na2S2O3=2NaI+Na2S4O6可知:ICl~2Na2S2O3,求出ICl的物质的量,
再根据方程式①可知,5.00g该油脂样品所消耗的ICl的物质的量.
(2)制备的氯气中含有氯化氢,可以用饱和食盐水除去氯气中的氯化氢;装置F中的水蒸气进入装置D中,会使ICl水解;
(3)ICl与ICl3的沸点相差较大;
(4)①碘遇淀粉显蓝色;
②滴定过程中需要不断振荡,如果不振荡,则单质碘不能完全反应;
③实验2中比实验1多消耗的溶液体积为(V2-V1)ml,其物质的量的是0.001a(V2-V1)mol,
根据方程式②ICl+KI=I2+KCl和③I2+2Na2S2O3=2NaI+Na2S4O6可知:ICl~2Na2S2O3,求出ICl的物质的量,
再根据方程式①可知,5.00g该油脂样品所消耗的ICl的物质的量.
解答:
解:(1)氯酸钾具有氧化性能把浓盐酸氧化生成氯气,则装置A中发生反应的化学方程式是KClO3+6HCl=KCl+3Cl2↑+3H2O;
故答案为:KClO3+6HCl=KCl+3Cl2↑+3H2O;
(2)浓盐酸易挥发生成的氯气中含有氯化氢,所以装置B中饱和食盐水的作用是除去氯气中的氯化氢,已知ICl易水解,若用装置F代替装置E,则装置F中的水蒸气会进入装置D中,使ICl水解,所以不能用装置F代替装置E;
故答案为:除去氯气中的氯化氢;装置F中的水蒸气会进入装置D中,使ICl水解;
(3)由于ICl与ICl3的沸点相差较大,因此若所制得的ICl中溶有少量ICl3杂质,提纯的方法是蒸馏,故答案为:C;
(4)①由于碘遇淀粉显蓝色,因此滴定过程中可用淀粉溶液作指示剂;故答案为:淀粉溶液;
②滴定过程中需要不断振荡,如果不振荡,则单质碘不能完全反应溶液就会褪色,从而导致消耗硫代硫酸钠的量减小,即会导致V1偏小;
故答案为:偏小;
③实验2中比实验1多消耗的溶液体积为(V2-V1)ml,则Na2S2O3的物质的量的是0.001a(V2-V1)mol,
根据方程式②ICl+KI=I2+KCl和③I2+2Na2S2O3=2NaI+Na2S4O6可知:ICl~2Na2S2O3,
所以ICl的物质的量是0.001a(V2-V1)mol×
,
由根据方程式①可知,5.00g该油脂样品所消耗的ICl的物质的量为0.001a(V2-V1)mol×
×
=5a(V2-V1)×10-3mol,故答案为:5a(V2-V1)×10-3.
故答案为:KClO3+6HCl=KCl+3Cl2↑+3H2O;
(2)浓盐酸易挥发生成的氯气中含有氯化氢,所以装置B中饱和食盐水的作用是除去氯气中的氯化氢,已知ICl易水解,若用装置F代替装置E,则装置F中的水蒸气会进入装置D中,使ICl水解,所以不能用装置F代替装置E;
故答案为:除去氯气中的氯化氢;装置F中的水蒸气会进入装置D中,使ICl水解;
(3)由于ICl与ICl3的沸点相差较大,因此若所制得的ICl中溶有少量ICl3杂质,提纯的方法是蒸馏,故答案为:C;
(4)①由于碘遇淀粉显蓝色,因此滴定过程中可用淀粉溶液作指示剂;故答案为:淀粉溶液;
②滴定过程中需要不断振荡,如果不振荡,则单质碘不能完全反应溶液就会褪色,从而导致消耗硫代硫酸钠的量减小,即会导致V1偏小;
故答案为:偏小;
③实验2中比实验1多消耗的溶液体积为(V2-V1)ml,则Na2S2O3的物质的量的是0.001a(V2-V1)mol,
根据方程式②ICl+KI=I2+KCl和③I2+2Na2S2O3=2NaI+Na2S4O6可知:ICl~2Na2S2O3,
所以ICl的物质的量是0.001a(V2-V1)mol×
| 1 |
| 2 |
由根据方程式①可知,5.00g该油脂样品所消耗的ICl的物质的量为0.001a(V2-V1)mol×
| 1 |
| 2 |
| 100ml |
| 10ml |
点评:本题考查了物质制备实验方案设计,侧重于实验原理、基本操作、物质性质、数据处理等知识的考查,主要考查了学生的实验操作能力和数据处理能力,题目难度中等.

练习册系列答案
相关题目
已知某反应的过程可用球棍模型表示如图:

下列说法不正确的是( )

下列说法不正确的是( )
| A、该过程表示的反应为:2H2+O2═2H20 |
| B、过程Ⅰ是吸热过程,过程Ⅲ是放热过程 |
| C、过程Ⅱ有化学键断裂 |
| D、该反应的能量变化不一定是热能形式 |
某有机物x可以还原生成醇,也可以氧化生成一元羧酸,该醇与该羧酸反应可生成分子式为C2H4O2的有机物.则下列说法中不正确的是( )
| A、x由三种元素组成 |
| B、x只有还原性 |
| C、x中含碳40% |
| D、x的分子中有甲基 |