题目内容
取20mL NaOH溶液平均分成两份,分别放入A、B两支试管中.向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如下表所示:
单位:mL
请回答下列问题
(1)少量CO2与NaOH溶液反应的离子方程式 ;过量CO2与NaOH溶液反应的化学方程式 ;
(2)试管A中通入CO2后所得溶液的溶质为 ;
(3)原NaOH溶液的物质的量浓度为 mol/L;
(4)滴加70mL盐酸时,A、B产生CO2的体积均为最大值,则x= mL.
单位:mL
| 盐酸体积 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| A产生CO2的体积 | 0 | 0 | 0 | 0 | 0 | 22.4 | 44.8 | 44.8 | 44.8 |
| B产生CO2的体积 | 0 | 0 | 22.4 | 44.8 | 67.2 | 89.6 | x | x | x |
(1)少量CO2与NaOH溶液反应的离子方程式
(2)试管A中通入CO2后所得溶液的溶质为
(3)原NaOH溶液的物质的量浓度为
(4)滴加70mL盐酸时,A、B产生CO2的体积均为最大值,则x=
考点:化学方程式的有关计算
专题:计算题
分析:(1)把少量CO2通入NaOH溶液中,反应生成碳酸钠和水,把过量二氧化碳通入氢氧化钠全溶液中,反应生成碳酸氢钠;
(2)根据所加盐酸和产生二氧化碳的体积关系确定A中所含溶质;
(3)根据所消耗盐酸计算出溶质的物质的量,据钠守恒计算出氢氧化钠的物质的量,进而计算氢氧化钠的浓度;
(4)从B中消耗盐酸和产生气体关系计算x.
(2)根据所加盐酸和产生二氧化碳的体积关系确定A中所含溶质;
(3)根据所消耗盐酸计算出溶质的物质的量,据钠守恒计算出氢氧化钠的物质的量,进而计算氢氧化钠的浓度;
(4)从B中消耗盐酸和产生气体关系计算x.
解答:
解:(1)把少量CO2通入NaOH溶液中,反应生成碳酸钠和水,反应的离子方程式为CO2+2OH-=CO32-+H2O;
把过量二氧化碳通入氢氧化钠溶液中生成碳酸氢钠,反应的化学方程式为CO2+NaOH=NaHCO3,
故答案为:CO2+2OH-=CO32-+H2O;CO2+NaOH=NaHCO3;
(2)由数据A可知从50mL到70mL为碳酸氢钠与盐酸反应,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,
所以n(NaHCO3)=n(HCl)=(70mL-50mL)×10-3L/mL×0.1mol/L=2×10-3mol,
前50mL盐酸,一部分与碳酸钠反应生成碳酸氢钠,则耗盐酸20mL,Na2CO3+HCl=NaHCO3+NaCl
n(Na2CO3)=n(NaHCO3)=2×10-3mol,则另30mL盐酸与氢氧化钠,
n(NaOH)=)=(50mL-20mL)×10-3L/mL×0.1mol/L=3×10-3mol,
故A中溶质为NaOH、Na2CO3,
故答案为:NaOH、Na2CO3;
(3)根据(2)可知,A中含n(Na2CO3)=2×10-3mol,n(NaOH)=3×10-3mol,根据钠守恒,原氢氧化钠的物质的量为:2n(Na2CO3)+n(NaOH)=2×2×10-3mol+3×10-3mol=7×10-3mol,c(NaOH)=
=
=0.7mol/L,
故答案为:0.7;
(4)从B中数据可知,从开始生成二氧化碳起,每增加10mL盐酸,二氧化碳增加22.4mL,故从60mL到70mL,二氧化碳还增加22.4mL,所以x=89.6mL+22.4mL=112mL
故答案为:112.
把过量二氧化碳通入氢氧化钠溶液中生成碳酸氢钠,反应的化学方程式为CO2+NaOH=NaHCO3,
故答案为:CO2+2OH-=CO32-+H2O;CO2+NaOH=NaHCO3;
(2)由数据A可知从50mL到70mL为碳酸氢钠与盐酸反应,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,
所以n(NaHCO3)=n(HCl)=(70mL-50mL)×10-3L/mL×0.1mol/L=2×10-3mol,
前50mL盐酸,一部分与碳酸钠反应生成碳酸氢钠,则耗盐酸20mL,Na2CO3+HCl=NaHCO3+NaCl
n(Na2CO3)=n(NaHCO3)=2×10-3mol,则另30mL盐酸与氢氧化钠,
n(NaOH)=)=(50mL-20mL)×10-3L/mL×0.1mol/L=3×10-3mol,
故A中溶质为NaOH、Na2CO3,
故答案为:NaOH、Na2CO3;
(3)根据(2)可知,A中含n(Na2CO3)=2×10-3mol,n(NaOH)=3×10-3mol,根据钠守恒,原氢氧化钠的物质的量为:2n(Na2CO3)+n(NaOH)=2×2×10-3mol+3×10-3mol=7×10-3mol,c(NaOH)=
| n |
| V |
| 7×10-3mol |
| 0.01L |
故答案为:0.7;
(4)从B中数据可知,从开始生成二氧化碳起,每增加10mL盐酸,二氧化碳增加22.4mL,故从60mL到70mL,二氧化碳还增加22.4mL,所以x=89.6mL+22.4mL=112mL
故答案为:112.
点评:本题考查混合物的有关计算,难度较大,关键根据表中盐酸的体积计算出NaOH、Na2CO3的物质的量,根据钠守恒计算氢氧化钠的物质的量.对反应中涉及反应原理也要清楚.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
下列解释事实的化学方程式或离子方程式,不正确的是( )
| A、工业上可用电解法制备Mg:MgCl2(熔融)═Mg+Cl2↑ |
| B、向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2═2HClO+CaCO3↓ |
| C、用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) |
| D、用FeSO4除去酸性废水中的Cr2O72-:Cr2O72-+Fe2++14H+═2Cr3++Fe3++7H2O |
湖北荆门某化工厂违规快递有毒化学品,因泄漏导致9人中毒,1人死亡.涉事有毒化学品名为氟乙酸甲酯(C3H5O2F),其具有-COO-结构的同分异构体还有(不考虑-O-F结构及立体异构)( )
| A、4种 | B、5种 | C、6种 | D、7种 |
利用如图装置,可完成很多电化学实验.下列有关叙述,正确的是( )
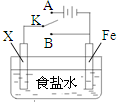

| A、若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | ||||
B、若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O
| ||||
| C、若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 | ||||
| D、若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 |
在指定环境下,下列各组离子可以大量共存的是( )
| A、在无色透明溶液中:Al3+、Na+、HCO3-、Cl- |
| B、在能使甲基橙呈红色的溶液中:Mg2+、NH4+、Fe2+、I- |
| C、加入铝粉放出氢气的溶液:K+、Ca2+、NO3-、SO42- |
| D、在水电离产生的H+的浓度为1×10-13mol?L-1的溶液:Cu2+、Na+、NO2-、SO42- |
 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(固定装置略去)
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(固定装置略去)