题目内容
7.科学家预言,燃料电池将是 21 世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,工作原理是将电极插入KOH溶液中,然后在两极分别添加甲醇和氧气,若a极上添加甲醇;b极:2H2O+O2+4e-═4OH-. 关于此燃料电池的下列说法中错误的是( )| A. | a极为负极,b极为正极 | |
| B. | 放电过程中,a、b电极上均发生氧化还原反应 | |
| C. | 该电池工作时添加甲醇的一极,附近溶液的碱性减弱,反应的离子方程式为:CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 若用此电源电解饱和食盐水,每消耗0.1molO2则阳极理论上生成0.2molCl2 |
分析 甲醇碱性燃料电池中,负极上通入燃料,正极上通入氧化剂,所以a为负极、b为正极,负极上发生氧化反应、正极上发生还原反应,负极反应式为CH3OH+8OH--6e-═CO32-+6H2O,正极反应式为2H2O+O2+4e-═4OH-,再结合转移电子相等计算.
解答 解:A.甲醇燃料电池中,通入燃料甲醇的电极是负极、通入氧化剂氧气的电极是正极,所以a是负极、b是正极,故A正确;
B.放电时,负极上失电子发生氧化反应,正极上得电子发生还原反应,故B错误;
C.负极上甲醇失电子和氢氧根反应生成碳酸根和水,导致氢氧根浓度降低,所以溶液的减性减弱,负极反应式为CH3OH+8OH--6e-═CO32-+6H2O,故C正确;
D.串联电路中转移电子相等,每消耗 0.1molO2则阳极理论上生成n(Cl2)=$\frac{0.1mol×4}{2}$=0.2mol,故D正确;
故选B.
点评 本题考查原电池和电解池原理,为高频考点,明确各个电极上发生的反应、反应类型及电极反应式的书写是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.有①苯、②苯酚、③甲苯3种有机化合物,分别与溴单质反应,相同条件下反应的难易程度为( )
| A. | ①>②>③ | B. | ②>③>① | C. | ②>①>③ | D. | 无法确定 |
18.把一定质量的铁完全溶解于某浓度的硝酸中收集到0.3mol NO2和0.2mol NO.向反应后的溶液中加入足量NaOH溶液充分反应,经过滤、洗涤后,把所得沉淀加热至质量不再减少为止.得到固体质量不可能为( )
| A. | 18 g | B. | 24 g | C. | 30 g | D. | 36 g |
15.在化学学习中使用数轴的表示方法可收到直观、形象的效果,下列表达中正确的是( )
| A. | 分散质微粒的大小与分散系种类的关系: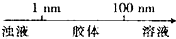 | |
| B. | 常温下溶液的pH其酸碱性的关系: | |
| C. | 硫的化合物中化合价与其氧化性、还原性的关系: | |
| D. | Na与O2反应的产物: |
2.下列关于NH4+、NH3、NH2-三种微粒的说法不正确的是( )
| A. | 三种微粒所含有的电子数相等 | B. | 三种微粒中氮原子的杂化方式相同 | ||
| C. | 三种微粒的空间构型相同 | D. | 键角大小关系:NH4+>NH3>NH2- |
12.原子利用率=期望产物的总质量与生成物的总质量之比,原子利用率越高对环境污染越小.在下列制备环氧乙烷的反应中,原子利用率最高的是( )
| A. |  $\stackrel{催化剂}{→}$ $\stackrel{催化剂}{→}$ +HOCH2═O═CH2OH+2H2O +HOCH2═O═CH2OH+2H2O | B. | CH2═CH2+Cl2+Ca(OH)2? +CaCl2+H2O +CaCl2+H2O | ||
| C. | CH2═CH2+ (过氧乙酸)? (过氧乙酸)? +C3HCOCH +C3HCOCH | D. | 2CH2═CH2+O2$\stackrel{催化剂}{→}$ |
19.NA为阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA | |
| B. | 在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA | |
| C. | 1.0L的0.1 mol•L-1Na2S溶液中含有的S2-离子数为0.1NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
16.图为烃分子的球棍模型,“大球”表示碳原子,“小球”表示氢原子.下列说法正确的是( )
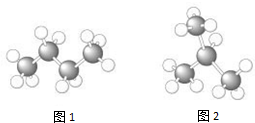

| A. | 图1表示的烃叫丙烷 | |
| B. | 图2烃分子的结构简式为CH3CH2CH2CH3 | |
| C. | 图1与图2表示的是同一种物质 | |
| D. | 图1与图2表示的物质互为同分异构体 |
13.向某含有SO32-、SiO32-、CO32-、Br-、Na+的溶液中缓慢通入Cl2直至过量,下列对该反应过程的判断正确的是( )
| A. | 整个过程共发生2个氧化还原反应 | |
| B. | 在该溶液中滴少量品红,品红褪色 | |
| C. | 所有离子的浓度都发生了变化 | |
| D. | 反应过程中氯气既作氧化剂又作还原剂 |