题目内容
将质量分数为a%,物质的量浓度为c1 mol?L-1的稀H2SO4蒸发掉一定量的水,使之质量分数为2a%,此时物质的量浓度为c2 mol?L-1,则c1和c2的数值关系是( )
| A、c2=c1 |
| B、c2<2c1 |
| C、c2>2c1 |
| D、c2=2c1 |
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:利用c=
计算硫酸的物质的量浓度,再根据硫酸溶液的浓度越大密度也越大,进行判断.
| 1000ρω |
| M |
解答:
解:设将溶质质量分数为a%的硫酸溶液密度为ρ1,
则c1=
mol/L=
mol/L,
设将溶质质量分数为2a%的硫酸溶液密度为ρ2,
则c2=
mol/L=
mol/L,
所以c1:c2=
mol/L:
mol/L=ρ1:2ρ2,
即c2=
c1
硫酸溶液的浓度越大密度也越大,所以ρ2>ρ1,所以
>2
所以c2>2c1,
故选:C.
则c1=
| 1000×ρ1×a% |
| 98 |
| 10aρ1 |
| 98 |
设将溶质质量分数为2a%的硫酸溶液密度为ρ2,
则c2=
| 1000×ρ2×2a% |
| 98 |
| 20aρ2 |
| 98 |
所以c1:c2=
| 10aρ1 |
| 98 |
| 20aρ2 |
| 98 |
即c2=
| 2ρ2 |
| ρ1 |
硫酸溶液的浓度越大密度也越大,所以ρ2>ρ1,所以
| 2ρ2 |
| ρ1 |
所以c2>2c1,
故选:C.
点评:本题考查物质的量浓度与质量分数的相互换算,可利用定义计算,难度中等,关键清楚硫酸溶液的浓度越大密度也越大,注意氨水、酒精浓度越大密度越小.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
下列不属于人体的微量元素的是( )
| A、碘 | B、铁 | C、锌 | D、钙 |
下列关于0.2mol/LBa(NO3)2溶液正确的说法是( )
| A、2L溶液中含有Ba+离子0.2mol |
| B、2L溶液中含有NO3-离子0.2mol |
| C、0.5L溶液中Ba2+离子的物质的量浓度为0.2mol/L |
| D、0.5L溶液中NO3-离子的物质的量浓度为0.2mol/L |
下列各项表达中正确的是( )
A、一CH3(甲基)的电子式为  |
B、硝基苯的结构简式: |
C、甲烷的电子式 |
D、聚丙烯的结构简式: |
下列说法中正确的是( )
①钠在空气中燃烧生成白色的氧化钠
②钠投入硫酸铜溶液中有红色粉末产生
③过氧化钠可在防毒面具中做供氧剂
④铁丝在氯气中燃烧生成棕红色的FeCl3
⑤纯净的氯气可以在中氢气安静燃烧,发出苍白色火焰
⑥氯气作用于干燥的品红试纸,试纸褪色.
①钠在空气中燃烧生成白色的氧化钠
②钠投入硫酸铜溶液中有红色粉末产生
③过氧化钠可在防毒面具中做供氧剂
④铁丝在氯气中燃烧生成棕红色的FeCl3
⑤纯净的氯气可以在中氢气安静燃烧,发出苍白色火焰
⑥氯气作用于干燥的品红试纸,试纸褪色.
| A、①② | B、②③ | C、③④ | D、①④ |
下列叙述正确的是( )
| A、1mol H2O的质量为18g?mol-1 |
| B、CO2的摩尔质量为44g |
| C、3.01×1023个SO2分子的质量为32g |
| D、64g氧气中含有2mol氧 |

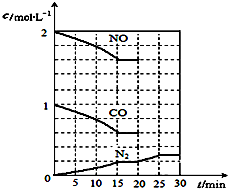 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.