题目内容
12.下列叙述中错误的是( )| A. | ⅢA族的B元素和ⅦA族的F元素能形成离子化合物BF3 | |
| B. | Na+和O2-电子层结构相同,Na+比O2-半径小 | |
| C. | IA族元素中,原子半径最大的金属性最强 | |
| D. | 第3周期元素中,原子序数最大的非金属性最强 |
分析 A、BF3是共价化合物;
B、电子层结构相同,核电荷数越大半径越小;
C、同主族从上往下电子层数越多半径越大,金属性越强;
D、稀有气体的化学性质很稳定.
解答 解:A、BF3是共价化合物,而不是离子化合物,故A错误;
B、电子层结构相同,核电荷数越大半径越小,钠的原子序数大于氧,所以Na+比O2-半径小,故B正确;
C、同主族从上往下电子层数越多半径越大,金属性越强,所以IA族元素中,原子半径最大的金属性最强,故C正确;
D、第3周期元素中,原子序数最大是Ar,故D错误;
故选AD.
点评 本题考查非金属性的比较,为高频考点,把握元素在周期表的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
2.下列关于有机物的说法错误的是( )
| A. | 乙烯和苯均能发生加成反应 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 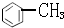 的一溴代物和 的一溴代物和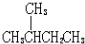 的一溴代物都有4种(不考虑立体异构) 的一溴代物都有4种(不考虑立体异构) | |
| D. | 乙酸乙酯、油脂、淀粉均能发生水解反应 |
3.有FeO、Fe2O3的混合物若干克,在足量H2气流中加热充分反应,冷却后称得剩余固体比原混合物减轻0.8g;将等质量的原混合物与盐酸反应,欲使之完全溶解,至少需要1mol/L盐酸的体积为( )
| A. | 0.1L | B. | 0.2L | C. | 0.5L | D. | 1.0L |
7.金属M与AgNO3溶液反应的化学方程式为M+2AgNO3=M(NO3)2+2Ag.若M是铜,则下列说法错误的是( )
| A. | M的金属活动性比Ag强 | B. | 反应后溶液的质量增加 | ||
| C. | 金属M不可能变换成铝 | D. | 固体物质的质量增加了 |
17.下列说法正确的是( )
| A. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2-3次 | |
| B. | 向酒精灯内添加酒精时,不能多于容积的$\frac{2}{3}$,若不慎洒出的酒精在桌上燃烧,应迅速用水灭火 | |
| C. | 探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合 | |
| D. | 配制浓硫酸和浓硝酸的混合酸时,将浓硝酸沿器壁慢慢加入浓硫酸中,并不断搅拌 |
3.某同学进行中和反应实验:取适量的NaOH溶液于烧杯中,滴加几滴紫色石蕊试液.再逐渐滴加稀H2SO4测得溶液的pH及颜色变化情况如表:
(1)图中符合上述实验过程的图形是C
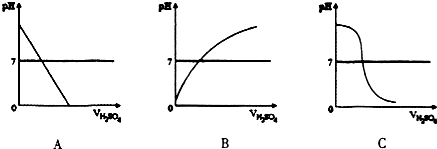
(2)当加人4ml稀H2SO4时,溶液显中性,溶液中的溶质为硫酸钠
(3)写出该中和反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O.
| 滴加稀H2SO4的体积ml | O | l | 2 | 3 | 4 | 5 | 6 | 7 |
| pH | 13.0 | 12.8 | 12.5 | 12.2 | 7.0 | 2.0 | 1.7 | 1.6 |
| 溶液颜色 | 蓝色 | 紫色 | 红色 | |||||

(2)当加人4ml稀H2SO4时,溶液显中性,溶液中的溶质为硫酸钠
(3)写出该中和反应的化学方程式2NaOH+H2SO4=Na2SO4+2H2O.
1.已知硫铁矿在沸腾炉中煅烧,通入沸腾炉中的气体原料是空气,其中N2的体积分数为0.80,则沸腾炉排出的气体中SO2的体积分数可能是( )
| A. | 0.13 | B. | 0.15 | C. | 0.22 | D. | 0.26 |