题目内容
 A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大.A、D同主族;A与B、C均可形成多种常见的10电子微粒;在同一周期中,简单离子半径E的最小,原子半径F的最小;B的单质分子中有三对共用电子对.请回答下列问题:
A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大.A、D同主族;A与B、C均可形成多种常见的10电子微粒;在同一周期中,简单离子半径E的最小,原子半径F的最小;B的单质分子中有三对共用电子对.请回答下列问题:(1)A、C两元素形成的原子个数比为1:1且呈电中性的微粒的电子式为
(2)A、C、D可形成化合物W,其含有的化学键有
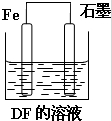
(3)用Fe、石墨作电极,与DF的溶液构成如图所示装置,正极的 电极反应为
(4)A2和B2在工业上可合成一种重要的原料BA3.
①下列的措施有利于提高B2的转化率的是
A.采用20~50MPa的大气压 B.选用400~500℃的高温C.使用催化剂 D.及时将BA3液化
②现有甲、乙两个密闭容器,在相同的体积和温度下,甲中充入2mol BA3,反应达到平衡时,吸收Q1 kJ的能量;乙中充入1mol B2和3mol A2,反应达到平衡时,放出Q2 kJ的能量;合成BA3的热化学方程式为:
(5)用D2C2在酸性条件下处理含CN-的工业废水,将得到N2及CO2等物质,请写出该反应的离子方程式
考点:位置结构性质的相互关系应用,原电池和电解池的工作原理
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F均为短周期主族元素,其原子序数依次增大,B的单质分子中有三对共用电子对,则B为氮元素,A与B、C均可形成多种常见的10电子微粒,则A氢元素,A、D同主族,所以D为钠元素,在同一周期中,简单离子半径E的最小,则E为铝元素,原子半径F的最小,则F为氯元素,据此答题;
解答:
解:A、B、C、D、E、F均为短周期主族元素,其原子序数依次增大,B的单质分子中有三对共用电子对,则B为氮元素,A与B、C均可形成多种常见的10电子微粒,则A氢元素,A、D同主族,所以D为钠元素,在同一周期中,简单离子半径E的最小,则E为铝元素,原子半径F的最小,则F为氯元素,
(1)A、C两元素形成的原子个数比为1:1且呈电中性,则C为氧元素,该化合物为H2O2,其电子式为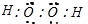 ,故答案为:
,故答案为: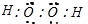 ;
;
(2)A、C、D可形成化合物NaOH,E为Al,NaOH中钠离子与氢氧根之间为离子键,氢氧根内部有共价键,NaOH与Al反应的离子方程式为2Al+2OH-+2H2O═2AlO-2+3H2↑,故答案为:离子键、共价键;2Al+2OH-+2H2O═2AlO-2+3H2↑;
(3)DF为NaCl溶液,用Fe、石墨作电极,构成原电池,电池正极是氧气得电子,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(4)①A2为氢气,B2为氮气,在合成氨工业中,由于该反应为气体体积减小的放热反应,所以要提高氮的转化率,可以增大压强,或者将氨液化,降低氨气的浓度,而提高温度会使氮气的转化率下降,催化剂对转化率没有影响,故答案为:AD;
②在相同的体积和温度下,甲中充入2mol NH3,乙中充入1mol N2和3mol H2,它们到达平衡时互为等效平衡,它们一个从正反应开始,一个从逆反应开始,所以合成氨的反应中,生成2molNH3放出的热量为(Q1+Q2) kJ/mol,所以热化学方程式为N2 (g)+3H2(g)?2NH3(g),△H=-(Q1+Q2) kJ/mol,
故答案为:N2 (g)+3H2(g)?2NH3(g),△H=-(Q1+Q2) kJ/mol;
(5)D2C2为Na2O2,根据题意,利用元素守恒和电荷守恒可以写出离子方程式为5Na2O2+2CN-+12H+=N2↑+2CO2↑+10Na++6H2O,
故答案为:5Na2O2+2CN-+12H+=N2↑+2CO2↑+10Na++6H2O.
(1)A、C两元素形成的原子个数比为1:1且呈电中性,则C为氧元素,该化合物为H2O2,其电子式为
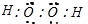 ,故答案为:
,故答案为: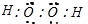 ;
;(2)A、C、D可形成化合物NaOH,E为Al,NaOH中钠离子与氢氧根之间为离子键,氢氧根内部有共价键,NaOH与Al反应的离子方程式为2Al+2OH-+2H2O═2AlO-2+3H2↑,故答案为:离子键、共价键;2Al+2OH-+2H2O═2AlO-2+3H2↑;
(3)DF为NaCl溶液,用Fe、石墨作电极,构成原电池,电池正极是氧气得电子,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(4)①A2为氢气,B2为氮气,在合成氨工业中,由于该反应为气体体积减小的放热反应,所以要提高氮的转化率,可以增大压强,或者将氨液化,降低氨气的浓度,而提高温度会使氮气的转化率下降,催化剂对转化率没有影响,故答案为:AD;
②在相同的体积和温度下,甲中充入2mol NH3,乙中充入1mol N2和3mol H2,它们到达平衡时互为等效平衡,它们一个从正反应开始,一个从逆反应开始,所以合成氨的反应中,生成2molNH3放出的热量为(Q1+Q2) kJ/mol,所以热化学方程式为N2 (g)+3H2(g)?2NH3(g),△H=-(Q1+Q2) kJ/mol,
故答案为:N2 (g)+3H2(g)?2NH3(g),△H=-(Q1+Q2) kJ/mol;
(5)D2C2为Na2O2,根据题意,利用元素守恒和电荷守恒可以写出离子方程式为5Na2O2+2CN-+12H+=N2↑+2CO2↑+10Na++6H2O,
故答案为:5Na2O2+2CN-+12H+=N2↑+2CO2↑+10Na++6H2O.
点评:本题主要考查了电子式、离子方程式、影响平衡的因素等知识点,综合性较强,难度中等,解题关键是先根据原子结构特点确定元素种类.

练习册系列答案
相关题目
己烯雌酚是一种激素类药物,结构如下列叙述中正确的是( )
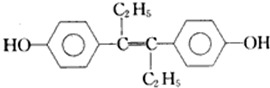

| A、该有机物分子中,最多可能有18个碳原子共平面 |
| B、该分子中有7个碳碳双键,可以与氢气1:7加成 |
| C、该分子对称性好,所以没有顺反异构 |
| D、标况下,1mol该有机物与足量金属钠反应可以放出22.4L的氢气 |
一定温度下,体积为2L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如表:下列说法正确的是( )
| 物质 | X | Y | Z |
| 初始物质的量(mol) | 0.2 | 0.2 | 0 |
| 平衡物质的量(mol) | 0.1 | 0.05 | 0.1 |
| A、反应可表示为2X+3Y?2Z,其平衡常数为8000 |
| B、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| C、若将容器的体积压缩至1L,则X的体积分数减小,浓度增大 |
| D、若升高温度时,Z的浓度增大,可知温度升高时正反应速率增大,逆反应速率减小,平衡朝正反应方向移动 |
下列物质:①H3O+ ②[B(OH)4]- ③CH3COO ④NH3 ⑤CH4⑥NH4+中存在配位键的是( )
| A、①②⑥ | B、①③⑤ |
| C、③④⑤ | D、②④⑥ |
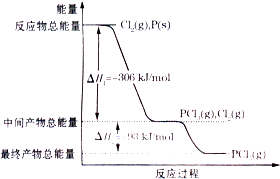 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).下列说法正确的是( )
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).下列说法正确的是( )| A、P(s)和Cl2(g)一步直接生成1 mol PCl5(g) 的△H小于△H1+△H2 |
| B、PCl5(g)?PCl3(g)+Cl2(g)加入催化剂,达平衡时PCl5的分解率减小 |
| C、生成PCl3(g)的热化学方程式为2P(s)+3Cl2(g)=2PCl3(g)△H=-306 KJ/mol |
| D、工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,降温后,再和Cl2反应生成PCl5,这样有助于提高产率 |
在下列分子中,能够在同一个平面内的原子数最多的是( )
| A、甲烷(CH4) |
| B、一溴甲烷(CH3Br) |
| C、乙烯(CH2═CH2) |
| D、CH2═C-HC≡CH |

 写出下列反应的热化学方程式.
写出下列反应的热化学方程式.