题目内容
19.设NA为阿伏伽德罗常数的值,下列说法正确的是( )| A. | 含NA个阴离子的Na2O2溶于水形成1L溶液,其物质的量浓度为2mol/L | |
| B. | 25g质量分数为68%的H2O2水溶液中含有氧原子数目为NA | |
| C. | 标准状况下,22.4L H2O含有的分子数为NA | |
| D. | 用5mL 3mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015NA |
分析 A、过氧化钠后生成氢氧化钠;
B、双氧水溶液中,除了双氧水外,水也含氧原子;
C、标况下水为液体;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、过氧化钠由2个阳离子和1个阴离子构成,故含NA个阴离子的过氧化钠的物质的量为1mol,而1mol过氧化钠溶于水后生成2mol氢氧化钠,由于溶液体积为1L,故所得溶液的浓度为2mol/L,故A正确;
B、双氧水溶液中,除了双氧水外,水也含氧原子,由于此溶液中双氧水的物质的量即为n=$\frac{25g×68%}{34g/mol}$=0.5mol,含氧原子即为1mol,故溶液中的氧原子的个数多于NA个,故B错误;
C、标况下水为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故所含胶粒的个数小于0.015NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.

练习册系列答案
相关题目
10.25°C时,将两个Pt电极插入一定量的饱和Na2SO4溶液中进行电解,通电一段时间后,在阳极收集到a mol气体,同时有b g Na2SO4•10H2O晶体析出,若保持温度不变,则剩余的Na2SO4溶液的质量分数为( )
| A. | $\frac{71b}{161(b+36a)}$×100% | B. | $\frac{71}{161}$×100% | ||
| C. | $\frac{b}{b+36a}$×100% | D. | $\frac{71b}{161(b+18a)}$×100% |
7.下列叙述正确的是( )
①铁能被磁铁吸引 ②在人体的血红蛋白中含有铁元素
③镁在空气中可剧烈燃烧,并发出强光 ④铁能在氧气中剧烈燃烧,生成黑色的Fe3O4
⑤在空气中加热Cu可生成黑色CuO.
①铁能被磁铁吸引 ②在人体的血红蛋白中含有铁元素
③镁在空气中可剧烈燃烧,并发出强光 ④铁能在氧气中剧烈燃烧,生成黑色的Fe3O4
⑤在空气中加热Cu可生成黑色CuO.
| A. | ①②④⑤ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
14.下列各操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向石灰水中通入过量的CO2
②向Ca(ClO)2溶液中通入过量SO2
③向氢氧化铝胶体中逐滴滴入过量稀NaOH溶液
④向氯化钡溶液中逐渐通入过量二氧化碳
⑤向AgNO3溶液中逐滴滴入过量稀氨水
⑥向饱和碳酸钠溶液中逐渐通入过量二氧化碳.
①向石灰水中通入过量的CO2
②向Ca(ClO)2溶液中通入过量SO2
③向氢氧化铝胶体中逐滴滴入过量稀NaOH溶液
④向氯化钡溶液中逐渐通入过量二氧化碳
⑤向AgNO3溶液中逐滴滴入过量稀氨水
⑥向饱和碳酸钠溶液中逐渐通入过量二氧化碳.
| A. | ①②⑥ | B. | ①③⑤ | C. | ②④⑥ | D. | ③④⑤ |
4.常温下,下列微粒可以大量共存于同一溶液中的是( )
| A. | NH4+、CH3COO-、Ca2+、Cl- | B. | Fe3+、Ag+、SO42-、NO3- | ||
| C. | Cu2+、H+、S2-、NO3- | D. | I-、Fe3+、K+、Cl- |
11.已知某400mL待测液中可能含有Cl-、SO42-、CO32-、Fe3+和Na+五种离子中的若干种.取该溶液100mL,加入足量NaOH溶液产生红褐色沉淀,过滤、洗涤、灼烧得到1.6g固体,向上述溶液中加足量BaCl2溶液,得到4.66g沉淀,加入盐酸,沉淀不溶解.下列判断不正确的是( )
| A. | 待测液中一定存在SO42-、Fe3+、Cl-,可能存在Na+ | |
| B. | 待测液中:c(Cl-)≥0.2mol•L-1 | |
| C. | 另取100mL待测液加入足量Ba(OH)2溶液,可得6.8g沉淀 | |
| D. | 另取100mL待测液加入足量AgNO3溶液,可得2.87g沉淀 |

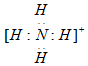 .写出实验室检验溶液中该离子的简单实验方案:取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有铵根离子.
.写出实验室检验溶液中该离子的简单实验方案:取适量待测液于试管中,加入适量NaOH溶液后加热,若产生无色有刺激性气味的气体,且能使试管口湿润的红色石蕊试纸变蓝,则证明溶液中含有铵根离子.