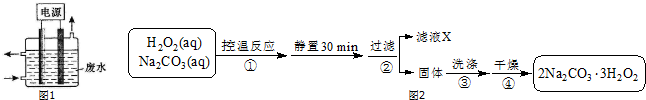
题目内容
9.室温下,将2g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6kJ的热量,写出C6H6燃烧热的热化学方程式C6H6(l)+$\frac{15}{2}$O2(g)→6CO2(g)+6H2O(l)△H=-3260.4KJ/mol.分析 依据题干条件计算符合热化学方程式对应量的焓变,根据热化学方程式的书写方法写出,注意物质聚集状态标注,焓变的正负.
解答 解:将2克液态苯(C6H6)物质的量=$\frac{2g}{78g/mol}$=$\frac{1}{39}$mol;完全燃烧生成液态水和CO2,放出83.6KJ的热量,1mol苯燃烧放热=83.6KJ×39mol=3260.4KJ;
反应的热化学方程式为:C6H6(l)+$\frac{15}{2}$O2(g)→6CO2(g)+6H2O(l)△H=-3260.4KJ/mol,
故答案为:C6H6(l)+$\frac{15}{2}$O2(g)→6CO2(g)+6H2O(l)△H=-3260.4KJ/mol;
故答案为:C6H6(l)+$\frac{15}{2}$O2(g)→6CO2(g)+6H2O(l)△H=-3260.4KJ/mol.
点评 本题考查了焓变计算、热化学方程式的书写方法注意问题,题目难度不大,明确反应热与物质的量之间的关系是解题的关键,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
20.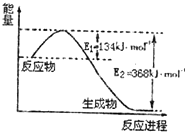 氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
(1)图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
其化学平衡常数K与温度t的关系如表:
完成下列问题:
①比较K1、K2的大小:K1>K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2vH2(正)=3vNH3(逆)
B.3vNH3(正)=2vH2(正)
C.容器内压强保持不变
D.混合气体的密度保持不变.
 氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.
氮是地球上含量较丰富的一种元素,氮及其化合物在工农业生产、日常生活中有着重要作用.(1)图是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1.
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
其化学平衡常数K与温度t的关系如表:
| t/℃ | 25 | 125 | 225 | … |
| K/(mol•L-1)-2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1>K2(填“>”、“=”或“<”).
②判断该反应达到化学平衡状态的依据是AC(填序号).
A.2vH2(正)=3vNH3(逆)
B.3vNH3(正)=2vH2(正)
C.容器内压强保持不变
D.混合气体的密度保持不变.
1.反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
①反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数为K,则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是BC(填序号).
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是BC(填序号).
A.容器中压强不
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO)=c(CO2)
18.关于蛋白质的下列说法正确的是( )
| A. | 蛋白质在体内代谢的最终产物是硝酸 | |
| B. | 灼烧蛋白质没有明显现象 | |
| C. | 误食重金属盐会使人中毒,应立即喝牛奶、豆浆解毒 | |
| D. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 |
19.在一真空固定体积的密闭容器中,充入10mol N2和30mol H2混合后发生反应:N2+3H2?2NH3.在一定温度下达到平衡,H2的转化率为20%.若在同一容器中充入NH3,欲使反应达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率是( )
| A. | 15mol 20% | B. | 20mol 20% | C. | 20mol 80% | D. | 40mol 80% |