题目内容
(8分)A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式) ,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示) 。
(2)由L、I两元素可按原子个数比1:l组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为 。
(3)固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生,写出该反应的离子方程式 。
(4)由A、B、C、D按原子个数比4:1:1:2形成一种化合物Y,则Y的化学式为 ,向Y中加足量稀硫酸后,再加高锰酸钾溶液,可使酸性高锰酸钾溶液褪色,写出使酸性高锰酸钾溶液褪色的离子方程式 。
(8分)
(1)SiH4, S2—>Na+>Al3+
(2)
(3)Na2O2 + S2—+ 2H2O = S↓+ 2Na++4OH—
(4)(NH4)2C2O4或N2H8C2O4, 2MnO4— + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O
或2MnO4— + 5C2O42— + 16H+ = 2Mn2+ + 10CO2↑+ 8H2O
【解析】
试题分析:9种元素属于三个周期,B、C、D属于同周期,则B、C、D应在第二周期,A是第一周期,所以A是H元素;E、F、G、L、I属于第三周期,A与E同主族,则E是Na元素; C、D、F三种元素的原子序数之和为28,C和D的最外层电子数之和为11,在第二周期元素中最外层电子数之和为11的主族元素为第五和第六主族,所以C是N元素、D是O元素,D与L分别为同一主族,则L是S元素; F的质子数比D多5,则F是Al元素;所以B与G 同主族,则B是C元素,G是Si元素,I是Cl元素。
(1)9种元素中非金属性最弱的是Si,氢化物的化学式为SiH4,E、F、L所形成的简单离子中,E与F的离子结构相同,则核电荷数少的离子半径大,L的电子层数最多,离子半径最大,所以三种离子的半径由大到小的顺序为S2—>Na+>Al3+;
(2)由Cl、S元素形成的1:1的化合物,,化合物X中各原子均满足8电子的稳定结构,1个S原子需要2个电子达到稳定结构,而1个Cl原子只需1个电子达到稳定结构,则Cl与S之间形成一对共用电子对,S与S之间形成一对共用电子对,所以化学式为S2Cl2,为共价化合物,所以电子式为 ;
;
(3)固体化合物过氧化钠投入到化合物硫化钠的水溶液中,只观察到有沉淀产生,过氧化钠与水反应产生氢氧化钠和氧气,说明氧气恰好与硫化钠反应生成S沉淀所以无气体放出,则离子方程式为Na2O2 + S2—+ 2H2O = S↓+ 2Na++4OH—;
(4)由H、C、N、O按原子个数比4:1:1:2形成一种化合物Y,则Y属于铵盐,化学式应是(NH4)2C2O4,草酸根离子具有还原性,与酸性高锰酸钾溶液发生氧化还原反应,生成二氧化碳气体,高锰酸根离子被还原为锰离子,离子方程式为2MnO4— + 5C2O42— + 16H+ = 2Mn2+ + 10CO2↑+ 8H2O。
考点:考查元素的推断,元素化合物的性质,化学用语的书写

下列所陈述的事实与解释均正确的是
选项 | 事实 | 解释 |
A | 用pH试纸测出新制氯水的pH为3 | 新制氯水有酸性 |
B | C2H5OH与浓硫酸共热170℃,制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
C | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
D | 甲苯能使酸性高锰酸钾溶液褪色 | 发生了萃取 |
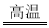 2K2SO4+2A12O3+9SO2↑+48H2O。
2K2SO4+2A12O3+9SO2↑+48H2O。 2SO3(g) ΔH=—197KJ/mol
2SO3(g) ΔH=—197KJ/mol 

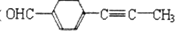 _____(填“是”或“不是”)1—萘酚的同分异构体。
_____(填“是”或“不是”)1—萘酚的同分异构体。