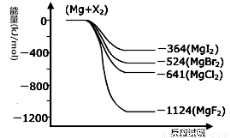
题目内容
下列所陈述的事实与解释均正确的是
选项 | 事实 | 解释 |
A | 用pH试纸测出新制氯水的pH为3 | 新制氯水有酸性 |
B | C2H5OH与浓硫酸共热170℃,制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
C | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
D | 甲苯能使酸性高锰酸钾溶液褪色 | 发生了萃取 |
C
【解析】
试题分析:A.在氯水中含有盐酸,有酸性,可以使pH变红色,但是其中还含有次氯酸,次氯酸有强的氧化性,会把红色物质氧化漂白变为无色,因此不能pH试纸测定溶液的pH及溶液的酸性,错误;B.C2H5OH与浓硫酸共热170℃,发生消去反应产生乙烯C2H4,制得的C2H4气体使酸性KMnO4溶液褪色,但是乙醇有挥发性,在制取的气体中含有乙醇,乙醇有还原性,也可以使酸性KMnO4溶液褪色,因此不一定是制得的乙烯使酸性KMnO4溶液褪色,错误;C. 铜与浓硝酸发生反应产生红棕色NO2气体,NO2在密闭容器则发生反应:2NO2(g) N2O4(g)。该反应的正反应是放热反应,若收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,根据平衡移动原理:降低温度,平衡向放热反应方向移动,对该反应来说,平衡正向移动,所以气体颜色变浅,正确;D.甲苯能使酸性高锰酸钾溶液褪色,是由于甲基被高锰酸钾溶液氧化为羧基,变为苯甲酸,不是由于发生萃取,错误。
N2O4(g)。该反应的正反应是放热反应,若收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,根据平衡移动原理:降低温度,平衡向放热反应方向移动,对该反应来说,平衡正向移动,所以气体颜色变浅,正确;D.甲苯能使酸性高锰酸钾溶液褪色,是由于甲基被高锰酸钾溶液氧化为羧基,变为苯甲酸,不是由于发生萃取,错误。
考点:考查陈述的化学反应事实与原因解释的正误判断的知识。

(12分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH2 =-566.0kJ/mol
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:

①工作一段时间后,测得溶液的pH减小。请写出该电池的负极的电极反应式。
②用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为 mol/L(假设电解前后溶液体积不变)。
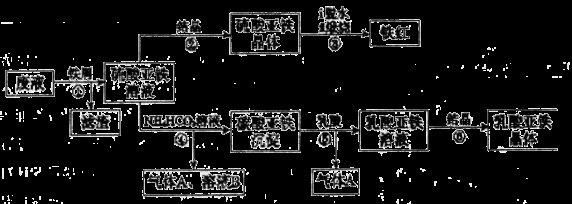
 Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。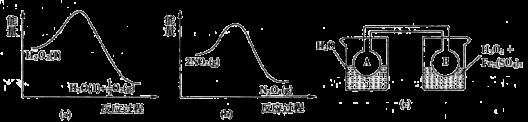

 CO2 (g) +H2(g) 获取。
CO2 (g) +H2(g) 获取。