题目内容
15.电解质的水溶液中存在电离平衡.(1)醋酸是常见的弱酸.
①醋酸在水溶液中的电离方程式为CH3COOH?H++CH3COO-.
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是bc(填字母序号).
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol•L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.

①滴定醋酸的曲线是I(填“I”或“Ⅱ”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是0.1mol•L-1醋酸溶液.
③V1和V2的关系:V1<V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c (Na+)>c (H+)>c (OH-).
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验.资料:AgSCN是白色沉淀
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1 AgNO3溶液 | 现象a出现白色沉淀,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1 KI溶液 | 出现黄色沉淀 |
②写出步骤2中溶液变红色的离子方程式Fe3++3SCN-?Fe(SCN)3.
③用化学平衡原理解释步骤3的实验现象浊液中存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
分析 (1)①醋酸是弱电解质,在水溶液里部分电离出醋酸根离子与氢离子;
②醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
(2)①根据浓度均为0.1mol•L-1的盐酸和醋酸溶液的pH不一样来回答;
②酸和碱都对水的电离起抑制作用,酸、碱性越强,水的电离程度越小,据此来判断;
③醋酸钠显示碱性,氯化钠显示中性;
④0.1mol•L-1 NaOH溶液10mL和溶液体积为20.00mL0.1mol•L-1的醋酸反应,得到的是醋酸和醋酸钠的混合物,据此确定离子浓度大小;
(3)①银离子会和硫氰酸根离子之间反应得到AgSCN白色沉淀;
②铁离子遇到硫氰化钾因发生反应而显示红色;
③沉淀向着更难溶的方向转化.
解答 解:(1)①醋酸是弱电解质,在水溶液里部分电离,电离方程式为:CH3COOH?H++CH3COO-,
故答案为:CH3COOH?H++CH3COO-;
②醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;
a.加入浓盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故错误;
b.醋酸的电离是吸热反应,加热CH3COOH溶液,促进醋酸的电离,则醋酸的电离程度增大,故正确;
c.加水稀释,促进醋酸的电离,则醋酸的电离程度增大,故正确;
d.加入少量醋酸钠,醋酸的电离平衡向逆反应方向移动,醋酸的电离程度降低,故错误;
故答案为:bc;
(2)①浓度均为0.1mol•L-1的盐酸和醋酸溶液的pH,盐酸的等于1,但是醋酸的大于1,所以滴定醋酸的曲线是I,
故答案为:I;
②0.1mol•L-1 NaOH溶液、0.1mol•L-1的盐酸中氢离子和氢氧根浓度都是0.1mol/L,对水的抑制作用一样,但是0.1mol/L醋酸溶液中氢离子浓度小于0.1mol/L,所以对水的电离抑制较小,即三种溶液中由水电离出的c(H+)最大的是0.1 mol•L-1醋酸溶液,
故答案为:0.1mol•L-1醋酸溶液;
③醋酸和氢氧化钠之间的反应,当恰好完全反应得到的醋酸钠显示碱性,要使得溶液显示中性,pH=7,需要醋酸稍过量,即醋酸消耗的氢氧化钠相对于盐酸少点,盐酸和氢氧化钠恰好完全反应,得到的氯化钠显示中性,所以V1<V2,
故答案为:<;
④用0.1mol•L-1 NaOH溶液10mL和溶液体积为20.00mL0.1mol•L-1的醋酸反应,得到的是醋酸和醋酸钠的混合物,显示酸性,此时离子浓度大小c(CH3COO-)>c (Na+)>c (H+)>c (OH-),
故答案为:c(CH3COO-)>c (Na+)>c (H+)>c (OH-);
(3)①加入硝酸银,Fe3++3SCN-?Fe(SCN)3,银离子会和硫氰酸根离子之间反应得到AgSCN白色沉淀,平衡左移溶液红色变浅,
故答案为:出现白色沉淀;
②铁离子遇到硫氰化钾显示红色,发生的反应为:Fe3++3SCN-?Fe(SCN)3,
故答案为:Fe3++3SCN-?Fe(SCN)3;
③AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,沉淀会向着更难溶的方向转化,即Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动,
故答案为:浊液中存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
点评 本题考查了弱电解质电离平衡、电离平衡常数影响因素分析、电解质溶液中离子浓度大小比较、溶度积常数的分析判断,掌握基础是解题关键,题目难度中等.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | CO 燃烧的热化学方程式为 2CO(g)+O2(g)═2CO2 (g)△H=+282.8kJ/mol | |
| B. | H2燃烧的热化学方程式为 2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | |
| C. | 燃烧前的混合气体中,H2的体积分数为40% | |
| D. | 混合气体燃烧后与足量的过氧化钠反应,转移电子2mol |
| A | B | C | D |
| ①能使溴的四氯化碳溶液褪色 ②比例模型为:  ③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为:  | ①由C、H、O两种元素组成; ②能与Na反应,但不能与NaOH溶液反应 ③能与D反应生成相对分子质量为100的酯 | ①由C、H、O两种元素组成; ②球棍模型为:  |

(2)B与D反应能生成相对分子质量为100的酯,该反应类型为该反应的化学反应方程式为CH2=CHCOOH+CH3CH2OH$\stackrel{催化剂}{→}$CH2=CHCOOCH2CH3+H2O.
(3)写出A与水在一定条件下反应生成C的方程式:CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH.
 甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )
甲、乙、丙、丁的相互转化关系如图所示(部分反应物及反应条件已略去,箭头表示一步转化).下列各组物质中,不能满足图示转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 丁 |
| A | CH≡CH | CH2=CH2 | CH2BrCH2Br | CH2OHCH2OH |
| B | NaAlO2 | Al(OH)3 | Al2O3 | Al |
| C | CH3CH2OH | CH3CHO | CH3COOH | CH3COOC2H5 |
| D | SiO2 | H2SiO3 | Na2SiO3 | Si |
| A. | A | B. | B | C. | C | D. | D |
| A. | v(NH3)=0.5 mol/(L•min) | B. | v(NH3)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.1mol/(L•min) | D. | v(NH3)=0.01 mol/(L•min) |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
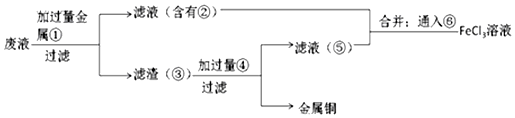
 .
.

 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.
+2NaBr.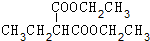 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr. .
. .
.