题目内容
5.铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题:(1)所含铁元素既有氧化性又有还原性的物质是C(用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是1-100nm.
(3)若要验证该溶液中含有Fe2+,正确的实验方法是D.
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+.
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+.
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+.
D.向试管中加入试液,滴入KSCN溶液无明显现象,再滴入氯水,若显血红色,证明原溶液中含有Fe2+.
(4)欲从有CuCl2和FeCl2废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:
加入①为金属Fe
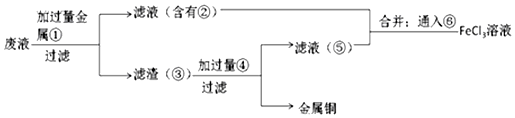
I.请写出上述实验中加入或生成的有关物质的化学式:
则滤渣③的成分Fe、Cu试剂④HCl.
II.请写出通入⑥发生的化学方程式2FeCl2+Cl2═2FeCl3.
分析 (1)处于中间价态的微粒既有氧化性又有还原性;
(2)至液体呈透明的红褐色得到的分散系为胶体;
(3)验证该溶液中含有Fe2+,利用其还原性,注意排除铁离子对亚铁离子检验的干扰;
(4)腐蚀废液中含有氯化铜、氯化亚铁,加入过量的铁可以和氯化铜反应生成金属铜和氯化亚铁,故①为Fe,经过滤所得滤液是氯化亚铁,滤渣是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量④为盐酸可以将铜分离,得到的滤液为氯化亚铁,滤液合并后通入氯气,能将亚铁离子氧化为三价铁,以此解答该题.
解答 解:(1)A.Fe中Fe元素的化合价为最低价,只有还原性,故A不选;
B.FeCl3与D.Fe2O3中Fe元素的化合价为高价,只具有还原性,故BD不选;
C.FeSO4中Fe元素的化合价为+2价,为中间价态,既有氧化性又有还原性,故C选;
故答案为:C;
(2)向沸水中逐滴滴加1mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系为胶体,可知粒子直径的范围是1~100nm,故答案为:1~100;)
(3)A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe3+,不能检验Fe2+,故A不选;
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,发生氧化还原反应,体现具有还原性的物质,可以是氯离子的还原性,不能证明含有Fe2+,故B不选;
C.向试管中加入试液,滴入氯水,可氧化亚铁离子,再滴入KSCN溶液,若显血红色,或原溶液中存在铁离子,则不能证明原溶液中含有Fe2+,故C不选;
D、向试管中加入试液,滴入KSCN溶液无明显现象,无铁离子,再滴入氯水,若显血红色,出现铁离子,证明原溶液中含有Fe2+.
故答案为:D;
(4)腐蚀废液中含有氯化铜、氯化亚铁,加入过量的铁可以和氯化铜反应生成金属铜和氯化亚铁,故A为Fe,经过滤所得滤液是氯化亚铁,滤渣是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量B为盐酸可以将铜分离,得到的滤液为氯化亚铁,滤液合并后通入氯气,能将亚铁离子氧化为三价铁,
①由上述分析可知,滤渣③的成分为Fe、Cu,④为HCl,故答案为:Fe、Cu;HCl;
②C为氯气,通入C和氯化亚铁反应生成氯化铁,方程式为2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3.
点评 本题考查较综合,涉及混合物分离提纯流程、氧化还原反应、离子检验等,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握物质的性质及反应原理,综合性较强,题目难度不大.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案| A. | CO2的电子式 | B. | H2O2的电子式 | C. | HCI的电子式 | D. | Cl-的结构示意图  |
| A. | H2S2O7 | B. | H2S2O8 | C. | H2S3O10 | D. | H2S4O13 |
| A. | CCl4+H2$→_{△}^{催化剂}$ CHCl3+HCl | B. | 2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO | ||
| C. |  +HNO3$→_{50℃-60℃}^{浓H_{2}SO_{4}}$+H2O+ +HNO3$→_{50℃-60℃}^{浓H_{2}SO_{4}}$+H2O+ | D. |  +3H2$→_{△}^{Ni}$ +3H2$→_{△}^{Ni}$ |
| A. | 从C(石墨)=C(金刚石)△H=1.9 kJ•mol-1,可知金刚石比石墨更稳定 | |
| B. | 已知2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,则H2的燃烧热为285.8 kJ/mol | |
| C. | 在稀溶液中:H++OH-═H2O△H=-57.3kJ•mol-1,若将含1mol CH3COOH的醋酸溶液与含1 mol Ba(OH)2的溶液混合,放出的热量小于57.3 kJ | |
| D. | 图中a曲线表示合成氨(放热反应)使用催化剂时,反应过程中的能量变化 |

| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 不能与饱和Na2CO3溶液反应 | |
| C. | 1mol化合物X最多能与8mol H2反应 | |
| D. | 在酸性条忤下水解,水解产物只有一种 |
(1)醋酸是常见的弱酸.
①醋酸在水溶液中的电离方程式为CH3COOH?H++CH3COO-.
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是bc(填字母序号).
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol•L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.

①滴定醋酸的曲线是I(填“I”或“Ⅱ”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是0.1mol•L-1醋酸溶液.
③V1和V2的关系:V1<V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c (Na+)>c (H+)>c (OH-).
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验.资料:AgSCN是白色沉淀
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1 AgNO3溶液 | 现象a出现白色沉淀,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1 KI溶液 | 出现黄色沉淀 |
②写出步骤2中溶液变红色的离子方程式Fe3++3SCN-?Fe(SCN)3.
③用化学平衡原理解释步骤3的实验现象浊液中存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: