题目内容
2.硫化钠俗称臭碱,在染料工业中用于生产硫化染料,工业上采用煤粉还原法来制备硫化钠,流程如图.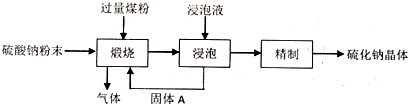
完成下列填空:
(1)将硫酸钠与磨碎的煤粉混合均匀,高温进行煅烧,若煅烧所得气体是分子个数比为1:1的两种碳的氧化物,写出煅烧时发生的化学反应方程式8C+3Na2SO4$\frac{\underline{\;高温\;}}{\;}$3Na2S+4CO↑+4CO2↑.
(2)用稀碱作为浸泡液浸取硫化钠,然后依次经过过滤、蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫化钠晶体.
(3)煤粉还原法的优点是工艺简单,原料价廉.煤粉还原法的缺点是能耗高、污染重.
(4)请用化学方程式表示另一种制备Na2S的方法2NaOH+H2S=Na2S+2H2O.
(5)某同学在实验室探究硫化钠与氯化铁的实验,产物受溶液的酸碱性以及反应物的量影响.
①向2mL盐酸酸化的氯化铁溶液中加入少量的硫化钠溶液,观察到有淡黄色固体生成,写出该反应的离子反应方程式2Fe3++S2-=2Fe 2++S↓.
②向2mL硫化钠溶液中加入少量氯化铁溶液,立即产生黑色沉淀,已知FeS与Fe2S3均为黑色难容与水的沉淀,请设计实验验证沉淀是FeS还是Fe2S3.
分析 工业上采用煤粉还原法来制备硫化钠,用过量的煤粉在高温下还原硫酸钠生成碳的氧化物和硫化钠,用稀碱溶液浸泡,再过滤,滤渣中含有未反应的煤粉可循环利用,滤液为硫化钠溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫化钠晶体,
(1)硫酸钠与碳反应生成硫化钠和两种碳的氧化物为CO和CO2,根据元素守恒和电子得失守恒书写化学反应方程式;
(2)从硫化钠溶液中获得硫化钠晶体,可以依次经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到;
(3)根据反应原理可知,煤粉还原法中需要高温,反应后产生CO有毒;
(4)制备Na2S也可以用氢氧化钠溶液和硫化氢气体发生中和反应;
(5)①向盐酸酸化的氯化铁溶液中加入少量的硫化钠溶液,铁离子能氧化硫离子生成硫单质和亚铁离子,所以观察到有淡黄色固体生成,根据电荷守恒和元素守恒书写反应的离子方程式;
②产生黑色沉淀可能为FeS或Fe2S3,根据①可知在,Fe2S3中加盐酸,铁离子与硫离子会发生氧化还原反应,有硫产生,而FeS中加入盐酸没有沉淀生成,据此可验证沉淀是FeS还是Fe2S3;
解答 解:工业上采用煤粉还原法来制备硫化钠,用过量的煤粉在高温下还原硫酸钠生成碳的氧化物和硫化钠,用稀碱溶液浸泡,再过滤,滤渣中含有未反应的煤粉可循环利用,滤液为硫化钠溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫化钠晶体,
(1)硫酸钠与碳反应生成硫化钠和两种碳的氧化物为CO和CO2,化学反应方程式为8C+3Na2SO4$\frac{\underline{\;高温\;}}{\;}$3Na2S+4CO↑+4CO2↑,
故答案为:8C+3Na2SO4$\frac{\underline{\;高温\;}}{\;}$3Na2S+4CO↑+4CO2↑;
(2)从硫化钠溶液中获得硫化钠晶体,可以依次经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到,
故答案为:蒸发浓缩、冷却结晶;
(3)根据反应原理可知,煤粉还原法中需要高温,能耗高,反应后产生CO有毒,污染环境,
故答案为:能耗高、污染重;
(4)制备Na2S也可以用氢氧化钠溶液和硫化氢气体发生中和反应,反应方程式为2NaOH+H2S=Na2S+2H2O,
故答案为:2NaOH+H2S=Na2S+2H2O;
(5)①向盐酸酸化的氯化铁溶液中加入少量的硫化钠溶液,铁离子能氧化硫离子生成硫单质和亚铁离子,所以观察到有淡黄色固体生成,反应的离子方程式2Fe3++S2-=2Fe 2++S↓,
故答案为:2Fe3++S2-=2Fe 2++S↓;
②产生黑色沉淀可能为FeS或Fe2S3,根据①可知在,Fe2S3中加盐酸,铁离子与硫离子会发生氧化还原反应,有硫产生,而FeS中加入盐酸没有沉淀生成,所以验证沉淀是FeS还是Fe2S3,实验操作为:在黑色沉淀中加入盐酸,如果溶液中出现淡黄色固体,则该沉淀物是Fe2S3,若无黄色沉淀出现,则是FeS,
故答案为:在黑色沉淀中加入盐酸,如果溶液中出现淡黄色固体,则该沉淀物是Fe2S3,若无黄色沉淀出现,则是FeS.
点评 本题以制备硫化钠为载体,涉及实验基本操作、氧化还原反应、实验方案设计,是对基础知识的综合应用,对学生综合能力有一定的要求,题目难度中等.

 53随堂测系列答案
53随堂测系列答案| A. | K+ | B. | Ba2+ | C. | Zn2+ | D. | Mg2+ |
| A. | 等物质的量的MgCl2、Ba(OH)2和HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| B. | NaHCO3溶液中加入稀HCl:CO32-+2H+═CO2↑+H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | Cu溶于稀HNO3:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
| A. | 0.1 | B. | 0.2 | C. | 0.4 | D. | 0.02 |
请回答下列问题:
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化为N2和CO2.
①已知部分化学键的键能如下
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O≡C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C≡O | N≡N |
| 键能(kJ/mol) | 632 | 1072 | 750 | 946 |
②若上述反应在恒温、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列图象符合题意的是D(填选项序号).(图甲中v正、K、n、P总分别表示正反应速率、平衡常数、物质的量和总压强)
(2)在t1℃下,向体积为10L的恒容密闭容器中通入NO和CO,测得了不同时间是NO和CO的物质的量如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(NO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(3)降低温度,NO2(g)将转化为N2O4(g),以N2O4、O2、熔断NaNO3组成的燃料电池装置如图1所示,在使用过程中石墨I电极反应生成一种氧化物Y,Y为N2O5,有关石墨I电极反应式看表示为N2O4+2NO3--2e-=2N2O5.
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.如图2,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率.反应原理为:NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g),相关说法正确的是AB.
A.上述反应的正反应为放热反应
B.催化剂①②分别适合于240℃和450℃脱氮
C.曲线①②最高点表示此时平衡转化率最高
D.相同条件下,改变压强对脱氮率没有影响

| A. | K+、Fe2+、NO3-、Cl-- | B. | K+、Al3+、SO42-、Cl- | ||
| C. | K+、NH4+、SO42-、Cl- | D. | Na+、K+、Br-、AlO2- |
| A. | 体积:①④③② | B. | 密度:④①③② | C. | 质量:①④③② | D. | 氢原子数:②④③① |