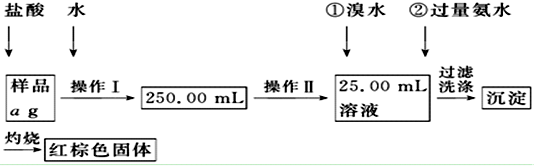
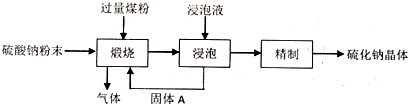
题目内容
19.在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,盐酸除表现出强还原性外,还表现出酸性.若有14.6gHCl被氧化,则生成Cl2的质量为14.2g.分析 依据盐酸在MnO2+4HCl(浓)═MnCl2+Cl2↑+H2O反应中化合价变化判断盐酸的作用,依据方程式可知消耗4mol氯化氢,只有2mol被氧化,生成1mol氯气,结合方程式计算若有14.6gHCl被氧化,生成氯气的质量.
解答 解:反应MnO2+4HCl(浓)═MnCl2+Cl2↑+H2O中,氯化氢中的氯元素有一半化合价升高被氧化,表现为还原性,另一半化合价不变,表现为酸性;
依据方程式MnO2+4HCl(浓)═MnCl2+Cl2↑+H2O可知,消耗4mol氯化氢,只有2mol被氧化,生成1mol氯气,则若有14.6gHCl被氧化,物质的量为$\frac{14.6g}{36.5g/mol}$=0.4mol,则生成氯气的物质的量为0.2mol,质量为:0.2mol×71g/mol=14.2g;
故答案为:酸;14.2.
点评 本题考查了氧化还原反应及有关方程式计算,明确化合价变化与物质氧化性、还原性关系是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列叙述正确的是( )
| A. | 除去CO2气体中的少量HCl:通入Na2CO3溶液洗气 | |
| B. | CH3COONa、BaSO4、NaOH都是强电解质 | |
| C. | Mg、Fe等金属在一定条件下与水反应都生成H2和对应的氢氧化物 | |
| D. | 浓硫酸、浓硝酸在加热条件下都能将木炭氧化为二氧化碳 |
7.下列仪器不能用酒精灯直接加热的是( )
| A. | 烧杯 | B. | 坩埚 | C. | 蒸发皿 | D. | 试管 |
14.维生素A1是一切健康上皮组织必需的物质,缺乏维生素A1时会引起儿童发育不良,导致夜盲症、皮肤干燥等.已知维生素A1的结构简式如下:
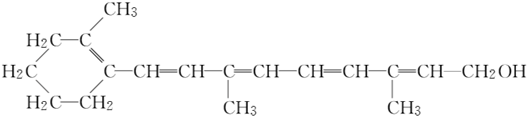
下列有关维生素A1的叙述错误的是( )

下列有关维生素A1的叙述错误的是( )
| A. | 维生素A1中含有两种官能团 | |
| B. | 维生素A1 的分子式为C18H26O | |
| C. | 维生素A1可使酸性高锰酸钾溶液褪色 | |
| D. | 维生素A1分子中含有苯环,1 mol维生素A1最多可与7 mol H2发生加成反应 |
4.某同学向一支试管中按一定的顺序分别加入下列几种物质(一种物质只加一次):a.KI溶液;b.淀粉溶液;c.NaOH溶液;d.稀硫酸;e.氯水.发现溶液颜色按如下顺序变化:①无色→②棕黄色→③蓝色→④无色→⑤蓝色.下列对此过程进行的分析中错误的是( )
| A. | 加入以上药品的顺序是a→e→b→c→d | |
| B. | ③→④反应的化学方程式为3I2+6NaOH═5NaI+NaIO3+3H2O | |
| C. | 溶液由棕黄色变为蓝色的原因是淀粉溶液遇碘变蓝色 | |
| D. | ④→⑤反应的粒子方程式为2I-+Cl2═I2+2Cl- |
19.下列说不正确的是( )
| A. | CH3CH(CH3)CH(CH3)2的系统名称是2,3一二甲基丁烷 | |
| B. | 石油化工中裂化是为了提高轻质油的产量和质量 | |
| C. | 维勒在制备氰酸铰时得到了尿素,打破了“生命力论”的统治地位 | |
| D. | 乙醇和浓硫酸加热到170°时发生脱水生成乙醚 |