题目内容
16.已知:(1)Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s),△H=-348.3kJ•mol-1,(2)2Ag(s)+$\frac{1}{2}$O2(g)═Ag2O(s),△H=-31.0kJ•mol-1,
则Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s)的△H等于( )
| A. | -379.3 kJ•mol-1 | B. | -317.3 kJ•mol-1 | C. | -332.8 kJ•mol-1 | D. | 317.3 kJ•mol-1 |
分析 根据已知的热化学反应方程式和目标反应,利用盖斯定律(1)-(2)可得目标反应Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s),据此计算出该反应的焓变.
解答 解:由(1)Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s),△H=-348.3kJ•mol-1,
(2)2Ag(s)+$\frac{1}{2}$O2(g)═Ag2O(s),△H=-31.0kJ•mol-1
根据盖斯定律可知,(1)-(2)可得Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s),则△H=(-348.3kJ•mol-1)-(-31.0kJ•mol-1)=-317.3kJ•mol-1,
故选B.
点评 本题考查学生利用盖斯定律计算反应的反应热,题目难度不大,明确盖斯定律的内容及应用方法为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
7.关于有机物的下列说法,错误的是( )
| A. | 石油裂解能得到乙烯,乙烯是生产聚乙烯的原料 | |
| B. | 甲烷、苯都属于烃,都不存在同分异构体 | |
| C. | 点燃甲烷前一定要检验其纯度 | |
| D. | 煤干馏为化学变化,石油分馏是物理变化 |
4.下列不属于人体必需元素的是( )
| A. | F | B. | N | C. | Zn | D. | Al |
11.下列事实不能说明一元酸HA为弱酸的是( )
| A. | 常温下0.1 mol•L-1的HA溶液pH为5 | |
| B. | HA溶液能与大理石反应 | |
| C. | HA溶液中存在H+、OH-、A-、HA | |
| D. | 常温下,向HA溶液的加入NaA固体,溶液的pH增大 |
1.下列关于核外电子排布的叙述中正确的是( )
| A. | 最外层一定为8个电子 | |
| B. | 第n层上最多容纳2n2个电子 | |
| C. | M层上的电子一定多于L层上的电子 | |
| D. | 稀有气体元素原子最外层电子数一定是所有元素中最多的 |
8.下列能结合血红蛋白,使人体中毒的是( )
| A. | 氮气 | B. | 二氧化碳 | C. | 氯气 | D. | 一氧化碳 |
5.下列反应中,属于加成反应的是( )
| A. | CH3CH3+Br2→CH3CH2Br+HBr | |
| B. | 2CH3CHO+O2 $→_{△}^{催化剂}$ 2CH3COOH | |
| C. | CH3CH=CH2+Br2→CH3CHBr-CH2Br | |
| D. | 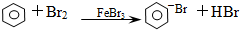 |
6.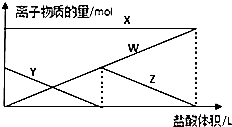 向aL1mol•L-1的Na2CO3的溶液中缓慢地滴加bL1mol•L-1的盐酸,并不断搅拌,随着盐酸的加入,溶液中离子物质的量也相应地发生变化如图所示(不考虑盐类的水解及水的电离),下列说法正确的是( )
向aL1mol•L-1的Na2CO3的溶液中缓慢地滴加bL1mol•L-1的盐酸,并不断搅拌,随着盐酸的加入,溶液中离子物质的量也相应地发生变化如图所示(不考虑盐类的水解及水的电离),下列说法正确的是( )
 向aL1mol•L-1的Na2CO3的溶液中缓慢地滴加bL1mol•L-1的盐酸,并不断搅拌,随着盐酸的加入,溶液中离子物质的量也相应地发生变化如图所示(不考虑盐类的水解及水的电离),下列说法正确的是( )
向aL1mol•L-1的Na2CO3的溶液中缓慢地滴加bL1mol•L-1的盐酸,并不断搅拌,随着盐酸的加入,溶液中离子物质的量也相应地发生变化如图所示(不考虑盐类的水解及水的电离),下列说法正确的是( )| A. | 四条线与溶液中离子的对应关系是:X:Na+;Y:CO32-;Z:Cl-;W:HCO3- | |
| B. | 当a<b<2a时,发生的离子方程式为:CO32-+H+=CO2↑+H2O | |
| C. | 当3b=2a时,发生的离子方程式为:HCO3-+H+=CO2↑+H2O | |
| D. | 当$\frac{a}{2}$<b<a时,溶液中HCO32-与CO32-的物质的量之比为b:(a-b) |





 .
.