题目内容
10.有起始体积相同的三个容器甲为固定容积,乙带有可移动的活塞,丙是固定容积的绝热容器.在起始温度相同时向其中分别充入1molA2和3molB2,发生如下反应A2+3B2?2Χ2,一段时间后都达到平衡,三容器中的A2的转化率大小为( )| A. | 甲>乙>丙 | B. | 乙>甲>丙 | C. | 丙>甲>乙 | D. | 甲>丙>乙 |
分析 在起始温度相同时向其中分别充入1molA2和3molB2,气体的物质的量减小,而乙带有可移动的活塞,所以乙平衡是体积小于甲,则乙平衡相当在甲平衡的基础加压;反应A2+3B2?2Χ2,正反应是放热反应,所以丙平衡状态相当于在甲平衡的基础升高温度,由此分析解答.
解答 解:在起始温度相同时向其中分别充入1molA2和3molB2,气体的物质的量减小,而乙带有可移动的活塞,所以乙平衡是体积小于甲,则乙平衡相当在甲平衡的基础加压,平衡正向移动,所以A2的转化率乙>甲;反应A2+3B2?2Χ2,正反应是放热反应,所以丙平衡状态相当于在甲平衡的基础升高温度,平衡逆向移动,所以A2的转化率甲>丙,则A2的转化率大小为乙>甲>丙,
故选:B.
点评 本题主要考查学生对表格数据的分析利用能力和利用勒夏特列原理分析平衡移动的思维,题目有一定难度.

练习册系列答案
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
20.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离产生的c(OH-)=1×10-13mol/L的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
18.化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )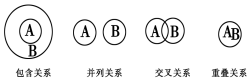

| A. | 化合物与电解质属于包含关系 | |
| B. | 氧化还原反应与化合反应属于包含关系 | |
| C. | 溶液与分散系属于并列关系 | |
| D. | 化合物与碱性氧化物属于交叉关系 |
5.下列说法正确的是( )
| A. | 增大反应物的浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂虽然不参加化学反应,但能增大单位体积内活化分子的数目,从而增大反应速率 |
15.分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)
| 物 质 | 需加入的试剂 | 有关离子方程式 |
| Cu(Fe) | ||
| ZnSO4(CuSO4) | ||
| NaOH[Ca(OH)2] |
16.已知A(g)+B(g)?C(g)+D(s)反应的平衡常数与温度的关系如下:
(1)该反应的平衡常数表达式K=$\frac{c(C)}{c(A)c(B)}$,△H>0(填“>、<、或=”);
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01mol•L-1•min-1,则2min时c(A)=0.06mol•L-1,C的物质的量为0.1mol;此时,该可逆反应是否达到平衡?否(填“是”或“否”)
(3)在此密闭容器中,下列选项能作为判断该反应达到平衡的依据有abd
a.压强不随时间改变 b.气体的密度不随时间改变
c.单位时间内消耗A和B的物质的量相等 d.C的百分含量保持不变
(4)880℃时,反应 C(g)+D(s)?A(g)+B(g)的平衡常数的值为0.067.
| 温度℃ | 700 | 800 | 880 | 1000 | 1200 |
| 平衡常数 | 1.0 | 10.0 | 15.0 | 16.1 | 17.7 |
(2)800℃时,向一个5L的密闭容器中充入0.4molA和0.7molB,若反应初始2mim内A的平均反应速率为0.01mol•L-1•min-1,则2min时c(A)=0.06mol•L-1,C的物质的量为0.1mol;此时,该可逆反应是否达到平衡?否(填“是”或“否”)
(3)在此密闭容器中,下列选项能作为判断该反应达到平衡的依据有abd
a.压强不随时间改变 b.气体的密度不随时间改变
c.单位时间内消耗A和B的物质的量相等 d.C的百分含量保持不变
(4)880℃时,反应 C(g)+D(s)?A(g)+B(g)的平衡常数的值为0.067.