题目内容
用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2恰好恢复到电解前的浓度和pH.则电解过程中转移电子的总物质的量为( )
| A、0.2mol |
| B、0.4mol |
| C、0.6mol |
| D、0.8mol |
考点:电解原理
专题:电化学专题
分析:根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,则铜离子和氢氧根放电,说明电解过程中电解的是硫酸铜和水后,继续电解部分水,依据电子守恒计算电子转移;
解答:
解:Cu(OH)2从组成上可看成CuO?H2O,加入0.2 mol Cu(OH)2后 恰好恢复到电解前的浓度和pH, 电解生成了0.2mol H2SO4 ,硫酸铜溶液电解完成后,又电解了0.2 mol H2O ,由电解的总反应式:
2H2O+?2CuSO4
2Cu+O2↑+2H2SO4 转移电子
2mol 4mol
0.2mol 0.4mol
2H2O
2H2↑+O2↑ 转移电子
2mol 4mol
0.2mol 0.4mol
所以电解过程中共转移电子为0.8mol.
故选:D.
2H2O+?2CuSO4
| ||
2mol 4mol
0.2mol 0.4mol
2H2O
| ||
2mol 4mol
0.2mol 0.4mol
所以电解过程中共转移电子为0.8mol.
故选:D.
点评:本题考查电解池的工作原理,先根据原子守恒计算析出铜单质的物质的量,再根据铜与转移电子之间的关系计算转移电子的物质的量,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
物质的量浓度相同的三种一元酸的钠盐NaX、NaY、NaZ溶液的pH分别为7、8、9,则同物质的量浓度的这三种一元酸的酸性由强到弱的顺序是( )
| A、HX、HY、HZ |
| B、HZ、HY、HX |
| C、HX、HZ、HY |
| D、HY、HX、HZ |
下列离子方程式正确的是( )
| A、碳酸钙加入稀盐酸中:CO32-+H+═H2O+CO2↑ |
| B、硫酸铜溶液与氢氧化钡溶液混合:Ba2++20H-+SO42-+Cu2+═BaSO4↓+Cu(OH)2+ |
| C、硝酸银溶液中加入铜粉:Ag++Cu═Ag+Cu2+ |
| D、铁粉加入稀盐酸中:2Fe+6H+═3H2↑+2Fe3+ |
下列说法正确的是( )
| A、氢氧化钠溶液应保存在带磨砂玻璃塞的无色细口瓶中 |
| B、硅是制造光导纤维的材料 |
| C、水玻璃可用作木材防火剂 |
| D、水晶是一种无色,坚硬难熔的硅酸盐 |
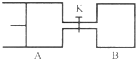 如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )
如图所示,向A和B中都充入2mol X和2mol Y,起始时VA=0.8aL,VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应X(g)+Y(g)?2Z(g)+W(g)△H<0,达到平衡时,VA=0.9aL,则下列说法错误的是( )| A、两容器中达到平衡的时间A<B |
| B、A容器中X的转化率为25%,且比B容器中X的转化率小 |
| C、打开K一段时间达到平衡时,A的体积为0.8aL(连通管中气体体积不计) |
| D、打开K达到新平衡后,升高B容器温度,A容器体积一定减小 |
将一定温度下的饱和硝酸钾溶液变为不饱和溶液,可以采取的方法是( )
| A、升温或加水 |
| B、降温或加水 |
| C、升温或蒸发水 |
| D、降温或蒸发水 |

