题目内容
18.3x+2y.分析 工业上黄铜矿(主要成分X是由Cu、Fe、S三种元素组成的盐)加硝酸溶解,生成Fe3+、Cu2+和硫酸根离子;把反应后的溶液分为两份,与Ba(NO3)2溶液,生成硫酸钡沉淀,根据硝酸钡求出硫酸根离子的物质的量,由元素守恒可得S的物质的量;
另一份加NaOH溶液生成氢氧化铁沉淀和氢氧化铜沉淀,根据消耗的NaOH计算Cu、Fe的物质的量,根据物质的量之比计算X的化学式.
解答 解:工业上黄铜矿(主要成分X是由Cu、Fe、S三种元素组成的盐)加硝酸溶解,生成Fe3+、Cu2+和硫酸根离子;把反应后的溶液分为两份,与Ba(NO3)2溶液,生成硫酸钡沉淀,已知n(Ba(NO3)2)=0.1L×0.600mol•L-1=0.06mol,则n(SO42-)=0.06mol,所以原固体中含有n(S)=0.06mol×2=0.12mol;
样品溶解后剩余的硝酸为2L×1mol/L=2mol,与硝酸反应的氢氧化钠为2mol,则生成沉淀消耗的NaOH为5.75mol•L-1×0.2L-1mol=0.3mol,
设11.04g黄铜矿中Fe为xmol,Cu为ymol;
则$\left\{\begin{array}{l}{3x+2y=0.3}\\{56x+64y+32×0.12=11.04}\end{array}\right.$,
解得:x=0.06mol,y=0.06mol;
所以样品中n(Fe):n(Cu):n(S)=0.06::0.06:0.12=1:1:2,则X的化学式为CuFeS2;
答:X的化学式为CuFeS2.
点评 本题考查了复杂化学式的确定,题目难度中等,注意把握原子守恒在计算中的应用,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
14.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
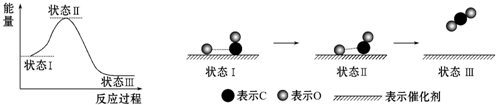
下列说法中正确的是( )

下列说法中正确的是( )
| A. | CO和O生成CO2是吸热反应 | B. | 状态Ⅰ→状态Ⅲ表示CO和O反应的过程 | ||
| C. | CO和O生成了具有非极性键的CO2 | D. | 在该过程中,CO断键形成C和O |
6.【物质结构与性质】.
X、Y、Z、W、J是元素周期表前四周期中的五种常见元素.其相关信息如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C;
(2)元素Y位于元素周期表第三周期第VIA族;
(3)元素Z的原子最外层共有7种不同运动状态的电子;基态Z原子中,电子占有的最高能层符号为3p;
(4)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1,W的基态原子核外价电子排布图是 ;
;
(5)元素Y与元素Z相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce;
a.常温下,Y的单质与Z的单质状态不同
b.Z的电负性大于Y
c.Z的氢化物比Y的氢化物稳定
d.在反应中,Y原子得电子数比Z原子得电子数多
e.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(6)J的元素名称氮,在周期表中位于p区.写出J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的离子方程式NH3+H+=NH4+.
X、Y、Z、W、J是元素周期表前四周期中的五种常见元素.其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | M层上有2对成对电子 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
| J | J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐 |
(2)元素Y位于元素周期表第三周期第VIA族;
(3)元素Z的原子最外层共有7种不同运动状态的电子;基态Z原子中,电子占有的最高能层符号为3p;
(4)W的基态原子核外电子排布式是1s22s22p63s23p63d104s1,W的基态原子核外价电子排布图是
 ;
;(5)元素Y与元素Z相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是bce;
a.常温下,Y的单质与Z的单质状态不同
b.Z的电负性大于Y
c.Z的氢化物比Y的氢化物稳定
d.在反应中,Y原子得电子数比Z原子得电子数多
e.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
(6)J的元素名称氮,在周期表中位于p区.写出J的气态氢化物与J的最高价氧化物对应的水化物可反应生成一种盐的离子方程式NH3+H+=NH4+.
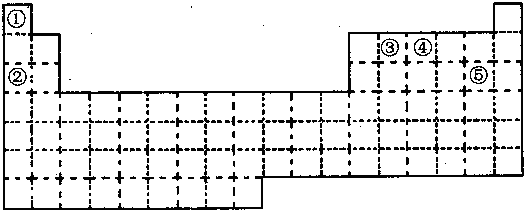
13.A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子序数之和等于B原子的原子序数.B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素的名称:氮、硫、氟.
(2)B位于元素周期表中第三周期ⅥA族.
(3)C的单质与H2反应的化学方程式为:H2+F2=2HF.
(4)写出A的最高价氧化物所对应的水化物与NaOH溶液反应的化学方程式为:NaOH+HNO3=H2O+NaNO3.
| A | C | |
| B |
(2)B位于元素周期表中第三周期ⅥA族.
(3)C的单质与H2反应的化学方程式为:H2+F2=2HF.
(4)写出A的最高价氧化物所对应的水化物与NaOH溶液反应的化学方程式为:NaOH+HNO3=H2O+NaNO3.
7.反应A+3B=2C+D在以下表示的反应速率中,速率最大的是( )
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(C)=0.5mol/(L•min) | D. | v (D)=0.45mol/(L•min) |