题目内容
NaF的熔点  的熔点(填>、=或<),其原因是 .
的熔点(填>、=或<),其原因是 .
 的熔点(填>、=或<),其原因是
的熔点(填>、=或<),其原因是考点:晶体的类型与物质熔点、硬度、导电性等的关系
专题:化学键与晶体结构
分析:组成离子化合物的阴阳离子的半径越小、电荷数越大,晶格能越大,离子化合物的熔点越高.
解答:
解:组成离子化合物的阴阳离子的半径越小、电荷数越大,晶格能越大,离子化合物的熔点越高,NaF和 均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,晶格能较小,因此熔点较低.
均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,晶格能较小,因此熔点较低.
故答案为:>;二者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低.
 均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,晶格能较小,因此熔点较低.
均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,晶格能较小,因此熔点较低.故答案为:>;二者均为离子化合物,且电荷数均为1,但后者离子半径大,离子键较弱,因此熔点较低.
点评:本题考查了离子化合物的熔点大小比较问题,注意影响熔点大小的因素为离子半径和离子所带电荷数,本题难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
下列说法不正确的是( )
| A、二氯乙烷存在二种同分异构体 |
| B、油脂在酸性条件下的水解产物都能与金属钠反应 |
| C、除去乙酸乙酯中少量的乙酸,用饱和碳酸钠溶液洗涤后分液 |
| D、等物质的量的甲烷与氯气混合气,在光照条件下生成的产物物质的量也相等 |
下列说法错误的是( )
| A、对废旧金属的最好处理方法是回收、再用 |
| B、提炼金属要经过矿石的富集、冶炼、精炼三步 |
| C、活泼金属的冶炼都是通过电解其盐溶液 |
| D、热还原法中还原剂有焦炭、一氧化碳、氢气或活泼金属等 |
下列说法正确的是( )
| A、加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+ |
| B、FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体剩余,加入KCSN溶液可能变成血红色 |
| C、常温下铝与浓硫酸不反应,与稀硫酸反应生成氢气 |
| D、加入NaOH溶液,产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+ |
M元素的一个原子失去两个电子并转移到Y元素的两个原子中,形成离子化合物Z,下列说法不正确的是( )
| A、Z的熔点较高 |
| B、Z可以表示为M2Y |
| C、Z一定溶于水 |
| D、M形成+2价的阳离子 |
下列有机反应方程式书写正确的是( )
A、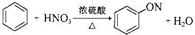 | |||
| B、H2C=CH2+Br2→CH3CHBr2 | |||
C、CH3COOH+CH3CH2OH
| |||
D、CH4+2O2
|
下列说法不正确的是( )
| A、钠是电和热的良导体 |
| B、钠在空气中燃烧生成氧化钠,并发出黄色火焰 |
| C、钠与硫化合时可以发生爆炸 |
| D、钠离子半径比钠原子半径大 |
