题目内容
15.下列说法中正确的是( )| A. | S在过量的O2中充分燃烧,可得SO3 | |
| B. | 除去在Na2CO3固体中混有的NaHCO3的最好办法是通入过量的CO2 | |
| C. | 鉴别NaHCO3溶液与Na2CO3溶液,可用澄清的石灰水 | |
| D. | 等物质的量的Na2CO3和NaHCO3与盐酸反应,消耗HCl的物质的量之比为2:1 |
分析 A.S在过量的O2中燃烧生成二氧化硫;
B.碳酸氢钠不稳定,加热易分解;
C.二者都与石灰水反应生成沉淀;
D.NaHCO3和Na2CO3都与盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2,结合方程式计算.
解答 解:A.S在过量的O2中燃烧生成二氧化硫,不能生成三氧化硫,二氧化硫在催化作用下可生成三氧化硫,故A错误;
B.碳酸氢钠不稳定,加热易分解,应用加热的方法除杂,故B错误;
C.二者都与石灰水反应生成沉淀,应加入氯化钙鉴别,故C错误;
D.NaHCO3和Na2CO3都与盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2,等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,放出CO2体积相等,消耗HCl的物质的量之比为2:1,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于学生的分析能力、实验能力的考查,注意把握物质的性质的异同以及实验的严密性、可行性的评价,难度不大.

练习册系列答案
相关题目
2.“优先反应思想”是一条重要的化学学科思想.根据所学知识及题目提供的相关数据,回答下列问题:
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+
用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红
(2)用惰性电极电解由等物质的量的NaBr,KI,NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2
(3)己知常温下一些电解质的相关数据见表:
①向等物质的量浓度的Na2C03,CH3COONa,NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是CO32-+H+=HCO3-
②向浓度均为0.010mot•L一1的NaCl,Na2Cr04组成的混合溶液中逐滴加入浓度为
0,.010mol•L -1AgN03溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100ML,浓度均为2mo1•L-1的FeC13溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
①根据表中的数据可求出粉末中铁、铜的物质的量之比为1:1.
②根据表中的数据分析I反应后的溶液中存在的金属阳离子有〔用离子符号表示)Fe3+、Fe2+、Cu2+.
(1)向FeBr2溶液中滴加少量氯水,溶液变黄.你认为使溶液变黄的微粒其符号是Fe3+
用实验证明你的观点,简述实验操作及现象取适量反应后的溶液滴加KSCN溶液变红
(2)用惰性电极电解由等物质的量的NaBr,KI,NaCl组成的混合溶液,阳极首先发生的电极反应式是2I--2e-=I2
(3)己知常温下一些电解质的相关数据见表:
| H2CO3 | K${\;}_{{\;}_{{a}_{1}}}$=4.3×10-7 | HClO | Ka=2.95×10-8 |
| K${\;}_{{a}_{2}}$=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
②向浓度均为0.010mot•L一1的NaCl,Na2Cr04组成的混合溶液中逐滴加入浓度为
0,.010mol•L -1AgN03溶液,首先生成的沉淀其化学式为AgCl.
(4)分别向四份各100ML,浓度均为2mo1•L-1的FeC13溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
②根据表中的数据分析I反应后的溶液中存在的金属阳离子有〔用离子符号表示)Fe3+、Fe2+、Cu2+.
6.下表是元素周期表的一部分.
(1)表列10种元素中,原子半径最大的是Na(填元素符号);某元素既可放在ⅠA也可放在ⅦA,该元素是H(填元素符号);非金属性最强的元素的原子结构示意图是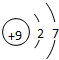 ;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)
;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)
(2)元素④和元素⑤相比较,气态氢化物稳定性较强的是H2O(填化学式),元素④氢化物的电子式是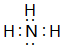 .
.
(3)元素⑤与元素⑨相比较,非金属性较强的是氧(填名称),可以验证该结论的实验是(b)(填编号).
(a) 将它们的氢化物溶于水,测PH值,比较溶液的酸性
(b) 取它们的单质分别与氢气反应,比较同物质的量放出热量的多少
(c) 加热两种元素的氢化物,比较它们的熔沸点高低
(4)⑤和⑦按1:1形成的化合物的化学式Na2O2
(5)写出元素⑦和元素⑧的最高价氧化物的水化物相互反应的化学方程式:NaOH+Al(OH)3=NaAlO2+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
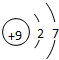 ;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)
;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)(2)元素④和元素⑤相比较,气态氢化物稳定性较强的是H2O(填化学式),元素④氢化物的电子式是
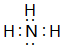 .
.(3)元素⑤与元素⑨相比较,非金属性较强的是氧(填名称),可以验证该结论的实验是(b)(填编号).
(a) 将它们的氢化物溶于水,测PH值,比较溶液的酸性
(b) 取它们的单质分别与氢气反应,比较同物质的量放出热量的多少
(c) 加热两种元素的氢化物,比较它们的熔沸点高低
(4)⑤和⑦按1:1形成的化合物的化学式Na2O2
(5)写出元素⑦和元素⑧的最高价氧化物的水化物相互反应的化学方程式:NaOH+Al(OH)3=NaAlO2+2H2O.
3.表是元素周期表的一部分,请回答有关问题:
(1)表中元素③是F(用元素符号表示),表中化学性质最不活泼的元素的原子结构示意图为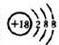 .
.
(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O=2KAlO2+3H2↑.
(3)④元素与⑦元素形成的化合物的电子式 .
.
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4.(填化学式)
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素是Al (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O=2KAlO2+3H2↑.
(3)④元素与⑦元素形成的化合物的电子式
 .
.(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4.(填化学式)
10.如表为元素周期表的一部分,用元素符号或化学式回答下列问题.
(1)10种元素中,化学性质最不活泼的是Ar,除⑩外原子半径最大的是K.
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH>NaOH>Al(OH)3
(3)①②③④⑤⑧六种元素形成的离子半径由大到小的顺序为S2->K+>Ca2+>Na+>Mg2+>Al3+
(4)元素⑦的氢化物的化学式为H2O;该氢化物和元素②单质反应的化学方程式为2K+2H2O=2KOH+H2↑.
(5)①⑨形成的化合物灼烧时火焰焰色为黄色;该化合物的溶液与元素⑧的单质反应的化学方程式为2NaBr+Cl2=2KCl+Br2.
(6)③的单质在⑥⑦形成化合物中燃烧的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;单质⑨溶入⑥⑧形成化合物所得溶液的颜色为橙红色;⑧⑨形成氢化物的稳定性由强到弱顺序为HCl>HBr.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是KOH>NaOH>Al(OH)3
(3)①②③④⑤⑧六种元素形成的离子半径由大到小的顺序为S2->K+>Ca2+>Na+>Mg2+>Al3+
(4)元素⑦的氢化物的化学式为H2O;该氢化物和元素②单质反应的化学方程式为2K+2H2O=2KOH+H2↑.
(5)①⑨形成的化合物灼烧时火焰焰色为黄色;该化合物的溶液与元素⑧的单质反应的化学方程式为2NaBr+Cl2=2KCl+Br2.
(6)③的单质在⑥⑦形成化合物中燃烧的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;单质⑨溶入⑥⑧形成化合物所得溶液的颜色为橙红色;⑧⑨形成氢化物的稳定性由强到弱顺序为HCl>HBr.
20.下列情况下,气体分子数相同的是( )
| A. | 标准状况下,71gCl2和22.4LHCl | B. | 相同质量的氢气和氮气 | ||
| C. | 在0℃时,1体积的O2和1体积的HCl | D. | 相同体积的CO2和 H2O |
7.下列说法不正确的是( )
| A. | 放热反应中反应物的总焓大于生成物的总焓 | |
| B. | 原子组成分子一定放出热量 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 化石燃料在地球上的蕴藏量是有限的,而且又都是经过亿万年才能形成的非再生资源 |
4.实验室中以下物质的贮存方法不正确的是( )
| A. | 少量金属钠保存在煤油中 | |
| B. | 试剂瓶中的液溴可用水封存,防止溴挥发 | |
| C. | 保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉 | |
| D. | 浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处 |