题目内容
 Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)利用反应6NO2+8NH3
| ||
| △ |
(2)已知:2SO2(g)+O2(g)═2SO3(g)△H=-196.6kJ?mol-1
2NO(g)+O2(g)═2NO2(g)△H=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H=
一定条件下,将NO2与SO2以体积比1:2置于容积固定的密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积之比为1:6,则平衡常数K=
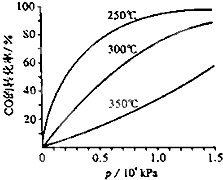
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)═CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H
Ⅱ.镍及其化合物与生产、生活密切相关.
(4)镍与CO反应,生成的Ni(CO)4受热易分解,化学反应方程式为Ni(s)+4CO(g)?(CO)4(g).吸烟时,烟草燃烧生成的CO吸入人体后会与血红蛋白结合成稳定的物质,使血液的携氧功能受到影响,同时烟草中少量Ni也与CO反应生成Ni(CO)4进入血液,并不断分解出Ni使人体重金属中毒.从化学平衡的角度分析,促使Ni(CO)4在血液中不断分解的原因是
(5)混合动力车通常使用碱性镍氢充放电池,其总反应为:H2+2NiOOH
| 放电 |
| 充电 |
考点:化学平衡状态的判断,化学电源新型电池,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)根据化合价的变化结合方程式计算;
(2)利用盖斯定律计算反应热;当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断;计算平衡时各物质的浓度,可计算平衡常数;
(3)由图可知温度越高,转化率越小;根据压强对化学反应速率以及化学平衡移动的影响知识结合实际生产过程来回答;
(4)依据血液中的血红蛋白会与一氧化碳结合,从而促进Ni(CO)4分解产生金属镍分析判断;
(5)依据总反应,充电过程是电解过程,阳极是元素化合价降低失电子发生氧化反应,写出电极反应.
(2)利用盖斯定律计算反应热;当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断;计算平衡时各物质的浓度,可计算平衡常数;
(3)由图可知温度越高,转化率越小;根据压强对化学反应速率以及化学平衡移动的影响知识结合实际生产过程来回答;
(4)依据血液中的血红蛋白会与一氧化碳结合,从而促进Ni(CO)4分解产生金属镍分析判断;
(5)依据总反应,充电过程是电解过程,阳极是元素化合价降低失电子发生氧化反应,写出电极反应.
解答:
解:(1)反应6NO2+8NH3
7N2+12H2O,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗
NO20.3mol,体积为6.72L,
故答案为:6.72;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1,
利用盖斯定律将①×
-②×
得NO2(g)+SO2(g)?SO3(g)+NO(g)
△H=
×(-196.6kJ?mol-1)-
×(-113.0kJ?mol-1)=-41.8kJ?mol-1,
a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(1a-x):(2a-x)=1:6,故x=
a,
故平衡常数K=
=
=
=2.67,
故答案为:-41.8;b;2.67;
(3)由图可知温度越高,转化率越小,则升高温度平衡逆移,所以正方向为放热方向,即△H<0;根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失,
故答案为:<;在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失;
(4)依据提示信息进入血液的Ni(CO)4使人体重金属中毒,可知血液中的血红蛋白会与一氧化碳结合,从而促进Ni(CO)4分解产生金属镍导致人体重金属中毒;
故答案为:Ni(CO)4进入血液后,一氧化碳和血红蛋白结合,平衡逆向进行,使人体内Ni增多;
(5)由于混合动力车通常使用碱性镍氢充放电池,气总反应为:H2+2NiOOH
2Ni(OH)2,当混合动力车在刹车或下坡时,电池处于充电状态,依据元素化合价变化和碱性电解质条件可知阳极电极反应为:Ni(OH)2+OH--e-=NiOOH+H2O;
故答案为:Ni(OH)2+OH--e-=NiOOH+H2O.
| ||
| △ |
NO20.3mol,体积为6.72L,
故答案为:6.72;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1,
利用盖斯定律将①×
| 1 |
| 2 |
| 1 |
| 2 |
△H=
| 1 |
| 2 |
| 1 |
| 2 |
a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误.
NO2(g)+SO2(g)?SO3(g)+NO(g)
起始物质的体积 a 2a 0 0
转化物质的体积 x x x x
平衡物质的体积 a-x 2a-x x x
平衡时NO2与SO2体积比为1:6,即(1a-x):(2a-x)=1:6,故x=
| 4 |
| 5 |
故平衡常数K=
| c(SO3)?c(NO) |
| c(NO2)?c(SO2) |
| x2 |
| (a-x)(2a-x) |
| 8 |
| 3 |
故答案为:-41.8;b;2.67;
(3)由图可知温度越高,转化率越小,则升高温度平衡逆移,所以正方向为放热方向,即△H<0;根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失,
故答案为:<;在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失;
(4)依据提示信息进入血液的Ni(CO)4使人体重金属中毒,可知血液中的血红蛋白会与一氧化碳结合,从而促进Ni(CO)4分解产生金属镍导致人体重金属中毒;
故答案为:Ni(CO)4进入血液后,一氧化碳和血红蛋白结合,平衡逆向进行,使人体内Ni增多;
(5)由于混合动力车通常使用碱性镍氢充放电池,气总反应为:H2+2NiOOH
| 放电 |
| 充电 |
故答案为:Ni(OH)2+OH--e-=NiOOH+H2O.
点评:本题考查了盖斯定律计算应用、化学平衡影响因素分析原理和方法应用、化学平衡常数的计算、电解原理分析,属于综合知识的考查,题目难度中等.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
下列关于原电池的叙述正确的是( )
| A、原电池是化学能转变为电能的装置 |
| B、构成原电池的正极和负极必须是两种不同的金属 |
| C、在原电池中,电子流出的一极是负极,该电极被还原 |
| D、原电池放电时,电流的方向是从负极到正极 |
向100mL FeBr2的溶液中,通入3molCl2.反应后溶液中Br-和Cl-的物质的量浓度相等,则溶液中发生反应的离子方程式为( )
| A、2Fe2++Cl2═2Fe3++2Cl- |
| B、2Br-+Cl2═Br2+2Cl- |
| C、4Fe2++2Br-+3Cl2═Br2+4Fe3++6Cl- |
| D、2Fe2++4Br-+3Cl2═2Br2+2Fe3++6Cl- |
有下列仪器:?①烧杯?②圆底烧瓶?③试管 ④锥形瓶 ⑤表面皿 ⑥坩埚,其中属于玻璃仪器,并可以用于加热的有( )
| A、??①②③④ |
| B、???④ |
| C、???④⑤ |
| D、???④⑤⑥ |
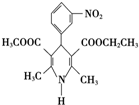 尼群地平片可用于治疗高血压.其药理作用是引起冠状动脉、肾小动脉等全身血管扩张,产生降压作用.它的主要成分的结构简式如下:
尼群地平片可用于治疗高血压.其药理作用是引起冠状动脉、肾小动脉等全身血管扩张,产生降压作用.它的主要成分的结构简式如下: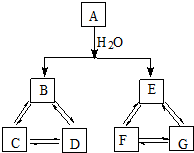 有A、B、C、D、E、F、G七种常见物质,它们满足下图所示转化关系.已知:
有A、B、C、D、E、F、G七种常见物质,它们满足下图所示转化关系.已知: