题目内容
(1)在CH4、H2S、NH4+、H2O、OH-、HCl、Na、Mg2+八种粒子中,选择符合下列要求的粒子填空:
①上述粒子中与K+质子数不同,电子数相同的有 ;
②上述粒子中与NH3质子数相同,电子数也相同的有 ;
③上述粒子中电子数大于质子数的有 .
(2)用锌片、铜片和稀硫酸组成的原电池,该电池的负极材料是 ,正极的电极反应式为 ,电池工作时电子流向 (填“正极”或“负极”).
(3)将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g)?xC(g)+2D(g).若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
①x的数值为 ;
②A的平均反应速率为 ;
③5min时B的转化率为 .
①上述粒子中与K+质子数不同,电子数相同的有
②上述粒子中与NH3质子数相同,电子数也相同的有
③上述粒子中电子数大于质子数的有
(2)用锌片、铜片和稀硫酸组成的原电池,该电池的负极材料是
(3)将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g)?xC(g)+2D(g).若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
①x的数值为
②A的平均反应速率为
③5min时B的转化率为
考点:化学平衡的计算,原电池和电解池的工作原理
专题:基本概念与基本理论
分析:(1)分子:核外电子数=质子数;阳离子:核外电子数=质子数-电荷数;阴离子:核外电子数=质子数+电荷数;
(2)依据原电池原理分析,活泼金属做负极失电子发生氧化反应,正极上是溶液中氢离子得到电子发生还原反应生成氢气;
(3)达到平衡时,容器内的压强变小,所以x=1,根据三段式解题法,求出A的反应速率、B的转化率,A的反应速率=
,B的转化率为
×100%.
(2)依据原电池原理分析,活泼金属做负极失电子发生氧化反应,正极上是溶液中氢离子得到电子发生还原反应生成氢气;
(3)达到平衡时,容器内的压强变小,所以x=1,根据三段式解题法,求出A的反应速率、B的转化率,A的反应速率=
| △c |
| △t |
| 消耗量 |
| 起始量 |
解答:
解:(1)①K+质子数为19,电子数为18,H2S、HCl的质子数都为18,电子数都为18,故答案为:H2S、HCl;
②NH3质子数为10,电子数为10,CH4、H2O的质子数都为10,电子数都为10,故答案为:CH4、H2O;
③阴离子中电子数大于质子数,故答案为:OH-;
(2)用锌片、铜片和稀硫酸组成的原电池,该电池的负极材料是锌片,正极为铜片,正极的电极反应式为2H++2e-=H2↑,电子流向从负极流向正极;
故答案为:锌片;2H++2e-=H2↑;正极;
(3)达到平衡时,容器内的压强变小,所以x+2<3+1,且x为整数,所以x=1;
平衡时,生成的D的物质的量为 0.2mol/(L﹒min)×5min×2L=2mol,
3A(气)+B(气)?C(气)+2D(气),
开始(mol):6 2 0 0
变化(mol):3 1 1 2
平衡(mol):3 1 1 2
①上述计算可知x的数值为1,故答案为:1;
②A的平均反应速率=
=0.3mol/(L﹒min),故答案为:0.3mol/(L﹒min);
③B的转化率=
×100%=50%,故答案为:50%.
②NH3质子数为10,电子数为10,CH4、H2O的质子数都为10,电子数都为10,故答案为:CH4、H2O;
③阴离子中电子数大于质子数,故答案为:OH-;
(2)用锌片、铜片和稀硫酸组成的原电池,该电池的负极材料是锌片,正极为铜片,正极的电极反应式为2H++2e-=H2↑,电子流向从负极流向正极;
故答案为:锌片;2H++2e-=H2↑;正极;
(3)达到平衡时,容器内的压强变小,所以x+2<3+1,且x为整数,所以x=1;
平衡时,生成的D的物质的量为 0.2mol/(L﹒min)×5min×2L=2mol,
3A(气)+B(气)?C(气)+2D(气),
开始(mol):6 2 0 0
变化(mol):3 1 1 2
平衡(mol):3 1 1 2
①上述计算可知x的数值为1,故答案为:1;
②A的平均反应速率=
| ||
| 5min |
③B的转化率=
| 1 |
| 2 |
点评:本题考查微粒中质子数和电子数的判断,化学平衡的计算应用,难度不大.要注意质子数与核外电子数的关系,掌握基础是关键,题目较简单.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
下列有关一定物质的量浓度的溶液配制的过程中,造成所得的溶液浓度偏大的是( )
| A、要配制100mL 1mol/L NaOH溶液,需在白纸上称4g NaOH固体,并且称量速度较慢 |
| B、称量时托盘天平的砝码已被锈蚀 |
| C、溶解或稀释溶质时烧杯尚未干燥 |
| D、定容时盖上瓶盖,摇匀后发现液面低于刻度线,再继续滴加蒸馏水使液面重新达到刻度线 |

 名称为
名称为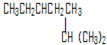 .
.