题目内容
在500℃时,向一恒容密闭容器中充入2mol X2和1mol Y2,发生反应:2X2(g)+Y2(g)?2Z(g),△H=-akJ/mol(a>0),充分反应达到平衡后,Z的物质的量浓度为Wmol/L,并放出b kJ的热量.试回答下列问题:
(1)若将温度降低到300℃,则化学平衡常数将 (填“增大”、“减小”、或“不变”)
(2)若向原来容器中只充入2mol Z,在500℃下充分反应并达到平衡后,吸收c kJ的热量,则a、b、c之间满足的关系是 (用代数式表示)
(3)能说明反应已达到平衡状态的是
A.C(Z)=2C(Y2) B.容器内压强保持不变 C.V逆(X2)=2V正(Y2) D.容器内密度保持不变.
(1)若将温度降低到300℃,则化学平衡常数将
(2)若向原来容器中只充入2mol Z,在500℃下充分反应并达到平衡后,吸收c kJ的热量,则a、b、c之间满足的关系是
(3)能说明反应已达到平衡状态的是
A.C(Z)=2C(Y2) B.容器内压强保持不变 C.V逆(X2)=2V正(Y2) D.容器内密度保持不变.
考点:化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)放热反应,降低温度,平衡向正反应移动,平衡常数增大;
(2)相同温度下,正、逆反应的反应热数值相等,但符号相反,令平衡时Z的物质的量为nmol,根据反应热计算两个过程的热量数值,据此判断;
(3)依据化学平衡的标志是正逆反应速率相同分析判断选项.
(2)相同温度下,正、逆反应的反应热数值相等,但符号相反,令平衡时Z的物质的量为nmol,根据反应热计算两个过程的热量数值,据此判断;
(3)依据化学平衡的标志是正逆反应速率相同分析判断选项.
解答:
解:(1)该反应正反应是放热反应,降低温度,平衡向正反应移动,平衡常数增大,
故答案为:增大;
(2)同一可逆反应,相同温度下,正、逆反应的反应热数值相等,但符号相反,令平衡时Z的物质的量为nmol,
对于反应2X2(g)+Y2(g)?2Z(g)△H=-akJ?mol-1,则b=n×
,对于反应2Z(g)?2X2(g)+Y2(g)△H=akJ?mol-1,Z分解的物质的量为(2-n)mol,故c=
×a=a-n×
,故a=b+c,
故答案为:a=b+c;
(3)平衡的标志是反应的正逆反应速率相同;
A.浓度c(Z)=2c(Y2),与起始量有关,不能说明达到平衡,故A错误;
B.反应是气体压强减小的反应,平衡状态容器内压强保持不变,说明反应达到平衡,故B正确;
C.依据反应速率之比等于化学方程式的系数之比,表示的是正反应速率,v逆(X2)=2v正(Y2),说明v逆(X2)=v正(X2),故C正确;
D.反应容器体积一定,气体质量守恒,反应过程和平衡状态容器内的密度保持不变,故D错误;
故选BC.
故答案为:增大;
(2)同一可逆反应,相同温度下,正、逆反应的反应热数值相等,但符号相反,令平衡时Z的物质的量为nmol,
对于反应2X2(g)+Y2(g)?2Z(g)△H=-akJ?mol-1,则b=n×
| a |
| 2 |
| 2-n |
| 2 |
| a |
| 2 |
故答案为:a=b+c;
(3)平衡的标志是反应的正逆反应速率相同;
A.浓度c(Z)=2c(Y2),与起始量有关,不能说明达到平衡,故A错误;
B.反应是气体压强减小的反应,平衡状态容器内压强保持不变,说明反应达到平衡,故B正确;
C.依据反应速率之比等于化学方程式的系数之比,表示的是正反应速率,v逆(X2)=2v正(Y2),说明v逆(X2)=v正(X2),故C正确;
D.反应容器体积一定,气体质量守恒,反应过程和平衡状态容器内的密度保持不变,故D错误;
故选BC.
点评:本题考查化学平衡常数、平衡状态判断,化学平衡的有关计算等,注意(4)中构建平衡建立的途径,题目难度中等.

练习册系列答案
相关题目
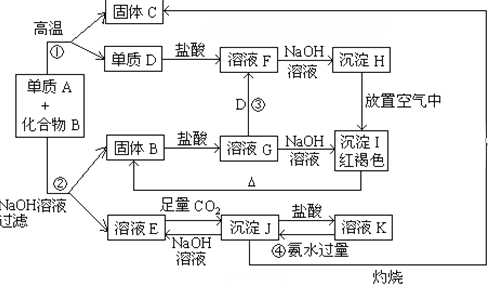
精制食盐水时下列物质中,不必用到的有( )
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液.
①NaOH溶液 ②盐酸 ③K2CO3溶液 ④BaCl2溶液 ⑤硫酸 ⑥Na2CO3溶液 ⑦Ba(NO3)2溶液.
| A、③④⑤ | B、③⑤⑦ |
| C、②⑤⑥ | D、②④⑤⑦ |
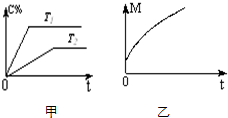 在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).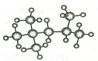 按系统命名法命名为:
按系统命名法命名为: