题目内容
取5.3g Na2CO3溶于水配成100ml溶液,求:
(1)Na2CO3物质的量浓度;
(2)Na+ 物质的量浓度;
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.4mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)
(1)Na2CO3物质的量浓度;
(2)Na+ 物质的量浓度;
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.4mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)
考点:物质的量浓度的相关计算
专题:计算题
分析:(1)根据n=
先求出Na2CO3的物质的量,再根据C=
求出物质的量浓度;
(2)根据Na2CO3的化学式可知,Na+ 物质的量浓度是的Na2CO3的浓度的2倍,据此计算;
(3)根据稀释定律C浓V浓=C稀V稀来计算.
| m |
| M |
| n |
| V |
(2)根据Na2CO3的化学式可知,Na+ 物质的量浓度是的Na2CO3的浓度的2倍,据此计算;
(3)根据稀释定律C浓V浓=C稀V稀来计算.
解答:
解:(1)根据n=
可知Na2CO3的物质的量n=
=0.05mol,根据C=
可知Na2CO3物质的量浓度C=
=0.5mol/L.
答:Na2CO3物质的量浓度为0.5mol/L;
(2)根据Na2CO3的化学式可知,Na+ 物质的量浓度是的Na2CO3的浓度的2倍,故Na+ 物质的量浓度C=0.5mol/L×2=1mol/L.
答:Na+ 物质的量浓度为1mol/L;
(3)设加入蒸馏水的体积为Vml,根据稀释定律C浓V浓=C稀V稀可知:
0.5mol/L×20ml×10-3=0.4mol/L×(20ml+Vml)×10-3
解得:X=5ml.
答:需加入蒸馏水的体积为5ml.
| m |
| M |
| 5.3g |
| 106g/mol |
| n |
| V |
| 0.05mol |
| 0.1L |
答:Na2CO3物质的量浓度为0.5mol/L;
(2)根据Na2CO3的化学式可知,Na+ 物质的量浓度是的Na2CO3的浓度的2倍,故Na+ 物质的量浓度C=0.5mol/L×2=1mol/L.
答:Na+ 物质的量浓度为1mol/L;
(3)设加入蒸馏水的体积为Vml,根据稀释定律C浓V浓=C稀V稀可知:
0.5mol/L×20ml×10-3=0.4mol/L×(20ml+Vml)×10-3
解得:X=5ml.
答:需加入蒸馏水的体积为5ml.
点评:本题考查了物质的量浓度的有关计算,熟记公式的使用以及物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
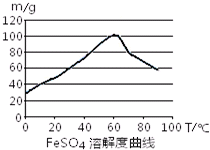 铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4
铁盐、亚铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用.用铁屑与硫酸反应制备FeSO4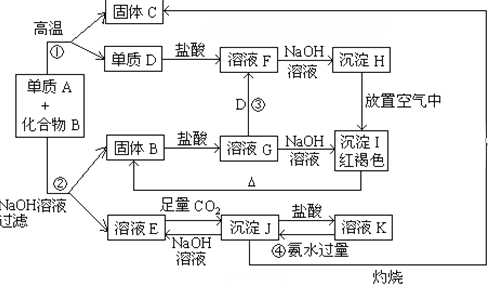
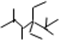 表示的分子名称是
表示的分子名称是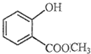 中含有的含氧官能团的名称为
中含有的含氧官能团的名称为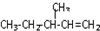 一定条件发生加聚反应时的化学方程式
一定条件发生加聚反应时的化学方程式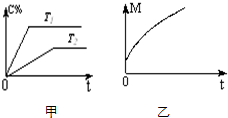 在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).
在密闭容器中投入一定量的A和B发生反应:m A(g)+n B(g)?p C(g)+q D(g).