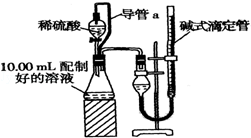
题目内容
11.将23g金属钠投入到100mL水中,使其充分反应,假设反应后溶液的体积不变.试计算:(1)反应后所得溶液溶质的物质的量浓度是多少?
(2)产生标准状况下的气体多少毫升?
(3)所得溶液与0.1mol/LH2SO4溶液恰好完全反应,则需要H2SO4溶液的体积为多少毫升?
分析 (1)发生反应:2Na+2H2O=2NaOH+H2↑,根据方程式计算NaOH物质的量,再根据c=$\frac{n}{V}$计算NaOH的物质的量浓度;
(2)根据方程式计算生成氢气的物质的量,再根据V=nVm计算氢气体积;
(3)发生反应:2NaOH+H2SO4=Na2SO4+H2O,则n(NaOH)=2n(H2SO4),进而计算需要硫酸的体积.
解答 解:(1)0.23g金属钠的物质的$\frac{23g}{23g/mol}$=1mol,
令生成的氢氧化钠的物质的量为ymol,则:
2Na+2H2O=2NaOH+H2↑
2 2
1mol ymol
所以2:2=1mol:ymol,解得y=1mol
故所得氢氧化钠溶液的物质的量浓度为$\frac{1mol}{0.1L}$=10mol/L,
答:反应后所得溶液溶质的物质的量浓度是10mol/L.
(2)令生成氢气的物质的量为xmol,则:
2Na+2H2O=2NaOH+H2↑
2 1
1mol xmol
故2:1=1mol:xmol,解得x=0.5
故标准状况下氢气的体积为0.5mol×22.4L/mol=11.2L=11200mL,
答:产生的氢气在标准状况下的体积为11200mL.
(3)发生反应:2NaOH+H2SO4=Na2SO4+H2O,所得溶液与0.1mol/LH2SO4溶液恰好完全反应,则n(NaOH)=2n(H2SO4),设需要H2SO4溶液的体积是V,则1mol=0.1mol/L×2×VL,解得V=5L=5000mL,
答:需要H2SO4溶液的体积为5000mL.
点评 本题考查化学方程式有关计算,比较基础,掌握以物质的量为中心的计算,理解化学方程式的意义.

(1)铜元素在元素周期表中的位置为第四周期ⅠB族,Cu+的核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10,基态铜原子核外电子共有29种运动状态.
(2)Cu2S在一定条件下可被氧化为CuSO4.
①在SO42-中S原子的杂化轨道类型为sp3;SiO44-、PO43-与 SO42-互为等电子体;其中Si、P、S第一电离能由大到小顺序为P>S>Si;
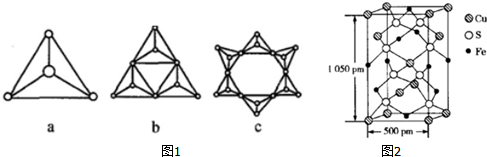
②硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元,硅氧四面体可以用图1a 表示,图1中b、c 是硅氧四面体结合成环状结构的两个例子,若在环状结构中硅的原子数为n,写出环状结构中硅酸根离子的通式SinO3n2n-.
(3)甲醇(CH3OH)中的羟基被硫羟基取代生成甲硫醇(CH3SH),二者部分物理性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 水溶液 |
| 甲醇 | -97 | 64.7 | 互溶 |
| 甲硫醇 | -123 | 6.8 | 不溶 |
(4)某化合物由S、Fe、Cu 三种元素组成,其晶胞结构如图2所示(1pm=10-10cm),该晶胞上下底面为正方形,侧面与底面垂直,则该晶体的密度ρ=4.66g/cm3(保留三位有效数字).
| A. | 18 g H2O所含的分子数为NA | |
| B. | 22.4 L H2O所含的分子数为NA | |
| C. | NA个氢原子的质量为2 g | |
| D. | 1 mol NaCl中含0.5NA个Na+和0.5NA个Cl- |
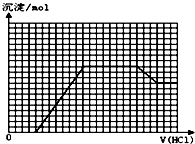 某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示(HCO3-与Al3+和AlO2-均要反应,不共存).下列判断正确的是( )
某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示(HCO3-与Al3+和AlO2-均要反应,不共存).下列判断正确的是( )| A. | 原溶液中可能含有NH4+、SO42- | |
| B. | 最终溶液中最少含2种溶质 | |
| C. | 原溶液中n(NaAlO2):n(Na2CO3)=1:1 | |
| D. | 滴加盐酸初始阶段发生反应的离子方程式是:CO32-+H+═HCO3- |
| A. | 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| C. | 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 | |
| D. | “血液透析”利用了胶体的性质 |
| A. | C3H6、C4H4O2 | B. | C3H8、C4H6O | C. | CH4O、C3H4O5 | D. | C2H2、C6H6 |