题目内容
2.设NA表示阿伏伽德罗常数,下列叙述不正确的是( )| A. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| B. | 7.8g Na2S固体和7.8g Na2O2固体中含有的阴离子数目均为0.1NA | |
| C. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数目为0.5NA | |
| D. | 0.5mol/LHCl 溶液中含有的氢离子数为0.05NA |
分析 A.乙烯和丙烯的最简式均为CH2;
B.硫化钠和过氧化钠的摩尔质量都是78g/mol,过氧化钠中的阴离子为过氧根离子;
C.依据n=$\frac{V}{Vm}$计算二氧化碳气体的物质的量,结合1个二氧化碳分子含有2个氧原子解答;
D.溶液体积未知.
解答 解:A.乙烯和丙烯的最简式均为CH2,故14g混合物中含1molCH2,故含2NA个氢原子,故A正确;
B.7.8g硫化钠和7.8g过氧化钠的物质的量均为0.1mol,0.1mol硫化钠、过氧化钠中都含有0.1mol阴离子,含有的阴离子数目均为0.1NA,故B正确;
C.标况下5.6L二氧化碳气体的物质的量为0.25mol,故含有的氧原子个数为0.5NA个,故C正确;
D.溶液体积未知,无法计算氢离子个数,故D错误;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大,注意气体摩尔体积所以条件和对象,注意过氧化钠的组成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列离子方程式,书写不正确的是( )
| A. | 大理石与盐酸反应 CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 氯化铁溶液中插入铜片:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 碳酸氢钠溶液与氢氧化钠反应:OH-+HCO3-═CO32-+H2O | |
| D. | 将铁片放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ |
13. 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应.下列说法不正确的是( )
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应.下列说法不正确的是( )
 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应.下列说法不正确的是( )
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应.下列说法不正确的是( )| A. | 氮化镓是一种新型无机非金属材料 | |
| B. | 铜电极表面的电极反应式:CO2+8H++8e-═CH4+2H2O | |
| C. | 溶液中H+穿过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量硫酸或盐酸 |
10.短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6:7,X的最高正价是W的最低负价的绝对值的2倍.下列说法正确的是( )
| A. | X单质可以通过铝热法获得 | |
| B. | X的氧化物和Z的最高价氧化物化合的产物中有共价键和离子键 | |
| C. | Y的氧化物是良好的半导体材料 | |
| D. | Z的氢化物比W的氢化物更稳定 |
7.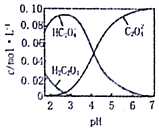 已知H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
已知H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
 已知H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
已知H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随PH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定正确的是( )| A. | PH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-) | |
| B. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| C. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| D. | PH=7的溶液中:c(Na+)>2 c(C2O42-) |
14. 新型夹心层石墨烯锂硫二次电池的工作原理可表示为16Li+xS8$?_{充电}^{放电}$8Li2Sx,其放电时的工作原理如图所示,下列有关该电池的说法正确的是( )
新型夹心层石墨烯锂硫二次电池的工作原理可表示为16Li+xS8$?_{充电}^{放电}$8Li2Sx,其放电时的工作原理如图所示,下列有关该电池的说法正确的是( )
 新型夹心层石墨烯锂硫二次电池的工作原理可表示为16Li+xS8$?_{充电}^{放电}$8Li2Sx,其放电时的工作原理如图所示,下列有关该电池的说法正确的是( )
新型夹心层石墨烯锂硫二次电池的工作原理可表示为16Li+xS8$?_{充电}^{放电}$8Li2Sx,其放电时的工作原理如图所示,下列有关该电池的说法正确的是( )| A. | 电池充电时X为电源负极 | |
| B. | 放电时,正极上可发生反应:2Li++Li2S4+2e-=2Li2S2 | |
| C. | 充电时,每生成1molS8转移0.2mol电子 | |
| D. | 离子交换膜只能通过阳离子,并防止电子通过 |
11.己知CO(g)+2H2(g)?CH3OH(g)是煤液化的一个反应,在温度T1和T2时将1molCO和3molH2充入2L密闭容器中测得n(CO)随时间(s)的变化如下表
下列说法正确的是( )
| 温度 n(CO) 时间 | 0 | 10 | 20 | … | 40 | 50 |
| T1 | 1.0 | 0.7 | 0.5 | … | 0.25 | 0.25 |
| T2 | 1.0 | 0.65 | 0.4 | … | 0.28 | 0.28 |
| A. | T1温度下平衡后恒容再充入0.5molCO,重新平衡后CO总的转化率与H2相等 | |
| B. | T1温度下10-20sH2的反应速率为0.04mol•L-1•s-1 | |
| C. | 该反应的△Η>0 | |
| D. | T2温度下平衡后恒定压强不变充入0.28molCH3OH,CH3OH的体积分数不变 |
19.下列各组元素中,属于同一周期的是( )
| A. | H、Na | B. | N、Cl | C. | Mg、Si | D. | O、S |
 (1)已知在常温常压下:
(1)已知在常温常压下: