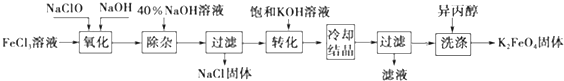
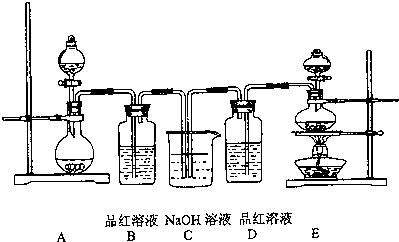
题目内容
19.某固体混合物可能由KCl、NaNO3、CuCl2、Na2SO4、Ca(NO3)2和K2CO3中的一种或几种组成,进行如下实验:①混合物加水后,形成无色透明的溶液;
②向①溶液中滴加BaCl2溶液,有白色沉淀产生,过滤;
③向②过滤出的白色沉淀物中加入稀盐酸,发现沉淀部分溶解;
④向②的滤液中加入AgNO3溶液,生成白色沉淀,再加入稀硝酸,沉淀不溶解.
根据以上实验,回答:
(1)混合物中一定含有Na2SO4、K2CO3,理由滴加BaCl2溶液,有白色沉淀产生,加入稀盐酸,沉淀部分溶解;
(2)混合物中一定没有CuCl2、Ca(NO3)2,理由溶液无色,且含有Na2SO4、K2CO3;
(3)不能判断是否含有KCl、NaNO3理由NaNO3与BaCl2溶液不反应,②操作中加入BaCl2溶液,引入氯离子.
分析 ①混合物中加入足量水得一无色透明溶液,说明不含CuCl2,
②滴加BaCl2有白色沉淀产生,③加盐酸时,沉淀部分溶解,说明生成的沉淀为BaCO3和BaSO4,则混合物中含有K2CO3、Na2SO4、,混合物中含有K2CO3,则一定不含有Ca(NO3)2,
④往滤液中加AgNO3溶液时有白色沉淀产生且白色沉淀不溶于稀硝酸,该沉淀为AgCl,但因②操作中加入BaCl2溶液不能确定是否含有KCl,以此解答该题.
解答 解:①混合物中加入足量水得一无色透明溶液,说明不含CuCl2,
②滴加BaCl2有白色沉淀产生,③加盐酸时,沉淀部分溶解,说明生成的沉淀为BaCO3和BaSO4,则混合物中含有K2CO3、Na2SO4、,混合物中含有K2CO3,则一定不含有Ca(NO3)2,
④往滤液中加AgNO3溶液时有白色沉淀产生且白色沉淀不溶于稀硝酸,该沉淀为AgCl,但因②操作中加入BaCl2溶液不能确定是否含有KCl,则
(1)由以上分析可知混合物一定含有Na2SO4、K2CO3,因滴加BaCl2溶液,有白色沉淀产生,加入稀盐酸,沉淀部分溶解,
故答案为:Na2SO4、K2CO3;滴加BaCl2溶液,有白色沉淀产生,加入稀盐酸,沉淀部分溶解;
(2)混合物中一定没有CuCl2、Ca(NO3)2,因溶液无色,且含有Na2SO4、K2CO3,否则与Na2SO4、K2CO3,反应生成沉淀,
故答案为:CuCl2、Ca(NO3)2;溶液无色,且含有Na2SO4、K2CO3;
(3)不能判断是否含有KCl、NaNO3,因NaNO3与BaCl2溶液不反应,②操作中加入BaCl2溶液,引入氯离子,
故答案为:KCl、NaNO3;NaNO3与BaCl2溶液不反应,②操作中加入BaCl2溶液,引入氯离子.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析、实验能力的考查,题目着重于考查物质的检验和鉴别,题目难度不大,本题注意根据物质反应的现象进行推断,学习中注重常见元素化合物知识的积累.

| A. | 1s22s22p5 | B. | 1s22s22p2 | C. | 1s22s22p63s1 | D. | 1s22s22p63s2 |
| A. | 将二氧化硫通入品红溶液,溶液显红色,加热后变为无色 | |
| B. | 向溶液中加入新制氯水,再滴加KSCN溶液,若溶液变红,则证明原溶液中一定含有Fe2+ | |
| C. | 将湿润的红纸条放进盛有氯气的集气瓶中,红纸条褪色 | |
| D. | 向酸性高锰酸钾溶液中滴加Na2SO3溶液,溶液无明显变化 |
| A. | 向某溶液中加入稀硝酸酸化,再滴入BaCl2溶液,产生白色沉淀,则原溶液中一定有SO42- | |
| B. | 向某溶液中加入稀硫酸酸化,再滴入AgNO3溶液,产生白色沉淀,则原溶液中一定有Cl- | |
| C. | 向某溶液中加入碳酸钠溶液,产生白色沉淀,再滴入稀盐酸,沉淀溶解,则原溶液中一定有Ca2+ | |
| D. | 用光洁的铂丝蘸取某无色溶液,在酒精灯外焰里灼烧时观察到黄色火焰,则原溶液中一定有Na+ |
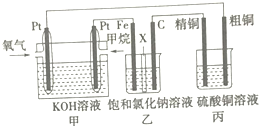 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜(含少量锌、金、银等杂质)的精炼原理,其中乙装置中X为阳离子交换膜.请按要求回答相关问题: