题目内容
4.吗啡和海洛因都是严格查禁的毒品.吗啡分子中C、H、N、O的质量分数分别为71.58%、6.67%、4.91%和16.84%,已知其相对分子质量不超过300.求:(1)一个吗啡分子中含1个氮原子
(2)吗啡的相对分子质量285
(3)吗啡的化学式C17H19NO3.
分析 吗啡分子含C:71.58%、H:6.67%、N:4.91%、其余为O,可知O的质量分数为16.84%,其相对分子质量不超过300,分子中N原子最大数目=$\frac{300×4.91%}{14}$=1.05,故吗啡分子中含有1个N原子,进而计算吗啡的相对分子质量,计算吗啡分子中C、H、O原子数目确定其分子式.
解答 解:(1)吗啡分子含C:71.58%、H:6.67%、N:4.91%、其余为O,可知O的质量分数为16.84%,其相对分子质量不超过300,分子中N原子最大数目=$\frac{300×4.91%}{14}$=1.05,故吗啡分子中含有1个N原子,
故答案为:1;
(2)N:4.91%,且含有1个N原子,则吗啡的相对分子质量=$\frac{14}{4.91%}$=285,
故答案为:285;
(3)吗啡分子中C原子数目=$\frac{285×71.58%}{12}$=17,H原子数目=$\frac{285×6.67%}{1}$=19,O原子数目=$\frac{285×16.84%}{16}$=3,吗啡分子中含有1个N原子,故吗啡的分子式为:C17H19NO3,
故答案为:C17H19NO3.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析、计算能力的考查,确定N原子数目是关键,难度中等.

练习册系列答案
相关题目
15.下列关于钠及其化合物的说法正确的是( )
| A. | 钠的密度比水大 | |
| B. | 碳酸钠可用于治疗胃酸过多 | |
| C. | 钠着火可用湿布盖灭 | |
| D. | 过氧化钠露置于空气中会变成碳酸钠 |
9.若阿伏加德罗常数的数值为NA,则下列说法中正确的是( )
| A. | 1 molFe与过量的氯气反应,转移电子的数目为2 NA | |
| B. | 2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA | |
| C. | 1.0L0.1 mol•L-1Na2S溶液中含有的S2-离子数小于0.1NA | |
| D. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
16.部分短周期元素的原子半径及主要化合价如表,判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.17 | 0.14 | 0.11 | 0.10 | 0.07 |
| 主要 化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与Q在同一周期 | |
| C. | M与T形成的化合物具有两性 | |
| D. | 最高价氧化物对应水化物的碱性:L<Q |
13.在N2+3H2?2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此段时间内用H2表示的平均反应速率为0.45mol/(L•s),则此段时间是( )
| A. | 1 s | B. | 2 s | C. | 44 s | D. | 1.33 s |
14.同温同压下,同质量的CO2与N2O不具有相同的( )
| A. | 分子数 | B. | 原子数 | C. | 密度 | D. | 化学性质 |
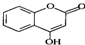 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成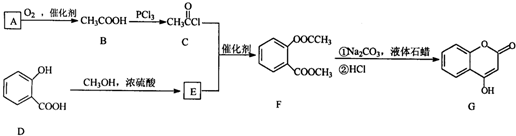
 .
.