题目内容
12.下列仪器名称为“分液漏斗”的是( )| A. |  | B. |  | C. |  | D. |  |
分析 分液漏斗是一种玻璃实验仪器,特别是涉及一种做化学实验用的分液漏斗.包括斗体,盖在斗体上口的斗盖.斗体的下口安装一三通结构的活塞,活塞的两通分别与两下管连接.
解答 解:A为烧杯,C为容量瓶,D为圆底烧瓶,B符合“分液漏斗”的特征, 为分液漏斗.
为分液漏斗.
故选B.
点评 本题考查常见仪器的使用和化学基本操作的方法,题目难度不大,注意在学习中加强基础知识的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
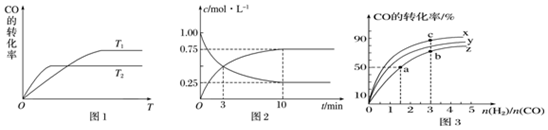
6.化学反应 A2(g)+B2(g)?2AB(g)的能量变化如图所示,下列叙述中正确的是( )

| A. | 每生成 2 个分子 AB 吸收(a-b) kJ 热量 | |
| B. | 该反应热△H=+(a-b)kJ•mol-1 | |
| C. | 逆反应的活化能高于正反应的活化能 | |
| D. | 断裂1mol A-A 和 1mol B-B 键,放出 a kJ 能量 |
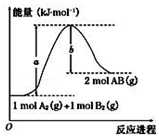
3.“分子机器设计和合成”有着巨大的研究潜力.人类步入分子器件时代后,使得光控、温控和电控分子的能力更强,下图是蒽醌套索醚电控开关.下列说法错误的是( )

| A. | 物质Ⅰ的分子式是C25H28O8 | B. | 反应是氧化反应 | ||
| C. | 1molⅠ可与8molH2发生加成反应 | D. | 物质Ⅰ的所有原子不可能共平面 |
17.W、X、Y、Z、T均是短周期主族元素,W和X同周期,W和Y同主族;W原子最外层电子数是内层电子数的两倍,X元素族序数是其所在周期数的三倍;X的阴离子与Z的阳离子的电子层结构相同;Z的单质与X的单质在不同条件下反应,可生成Z2X或Z2X2;T和Z同周期,且T是所在周期中原子半径最小的元素.下列叙述正确的是( )
| A. | Y与T形成的化合物中含有离子键 | |
| B. | X、Z、T对应的简单离子半径由大到小的顺序为T>X>Z | |
| C. | 1 mol Z的单质与足量X的单质反应,转移电子物质的量可能是2 mol,也可能是1 mol | |
| D. | X与Y形成的共价化合物XY2不能溶于强碱溶液 |
4.误服重金属盐可以立即采取的最合适的急救措施是( )
| A. | 大量喝水 | B. | 服用维生素C | C. | 喝适量牛奶 | D. | 喝食用醋 |
2.(1)100°C时,KW=1.0×10-12,在该温度下,测得0.1mol/LNa2A溶液pH=6.
①H2A在水溶液中的电离方程式为H2A=2H++A2-;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2一样多(填“多”、“少”或“一样多”).
(2)将0.4mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A-)<c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A-)=0.2mol/L.
(3)已知在常温下测得浓度均为0.1mol/L的下列5种溶液的pH,如表所示:
①少量二氧化碳通入NaClO溶液中的离子方程式ClO-+CO2+H2O=HCO3-+HClO;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是b(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c( CH3COO-)-c( CH3COOH)=2(10-6-10-8)mol/L(填准确数值).
①H2A在水溶液中的电离方程式为H2A=2H++A2-;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,H2A溶液产生的H2一样多(填“多”、“少”或“一样多”).
(2)将0.4mol/L HA溶液与0.2mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-):
①混合溶液中c(A-)<c(HA)(填“>”、“<”或“=”,下同);
②混合溶液中c(HA)+c(A-)=0.2mol/L.
(3)已知在常温下测得浓度均为0.1mol/L的下列5种溶液的pH,如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是b(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c( CH3COO-)-c( CH3COOH)=2(10-6-10-8)mol/L(填准确数值).